
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.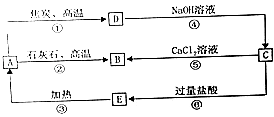
(1)写出各物质的化学式:A;C .
(2)写出反应①的化学方程式该反应中氧化剂与还原剂的物质的量之比为 .
(3)写出反应④的离子方程式: .
(4)写出反应⑤的离子方程式 .
(5)H2CO3的酸性强于E的酸性,请用离子方程式予以证明: .
【答案】
(1)SiO2;Na2SiO3
(2)2C+SiO2 ![]() Si+2CO;1:2
Si+2CO;1:2
(3)Si+2OH﹣+H2O=SiO32﹣+2H2↑
(4)SiO ![]() +Ca2+=CaSiO3↓
+Ca2+=CaSiO3↓
(5)SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]()
【解析】解:非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2 , B为CaSiO3 , C为Na2SiO3 , E为H2SiO3 , (1)由以上分析可知A为SiO2 , C为Na2SiO3 , 所以答案是:SiO2;Na2SiO3;(2)反应①的化学方程式为2C+SiO2 ![]() Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,所以答案是:2C+SiO2
Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,所以答案是:2C+SiO2 ![]() Si+2CO;1:2;(3)反应④的离子方程式为Si+2OH﹣+H2O=SiO
Si+2CO;1:2;(3)反应④的离子方程式为Si+2OH﹣+H2O=SiO ![]() +2H2↑,所以答案是:Si+2OH﹣+H2O=SiO
+2H2↑,所以答案是:Si+2OH﹣+H2O=SiO ![]() +2H2↑;(4)反应⑤的离子方程式为SiO
+2H2↑;(4)反应⑤的离子方程式为SiO ![]() +Ca2+=CaSiO3↓,所以答案是:SiO
+Ca2+=CaSiO3↓,所以答案是:SiO ![]() +Ca2+=CaSiO3↓;(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO
+Ca2+=CaSiO3↓;(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]() ,所以答案是:SiO
,所以答案是:SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]() .
.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电的锂离子电池,以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池总反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热
B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉
D. 加入少量1 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
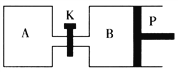
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中加入少量KMnO4酸性溶液,振荡后褪色,正确的解释为 ( )
A.苯的同系物分子中的碳原子数比苯分子中的碳原子数多
B.苯环受侧链影响易被氧化
C.侧链受苯环影响易被氧化
D.由于苯环和侧链的相互影响均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)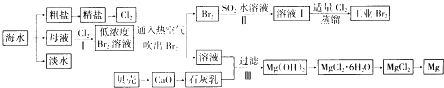
(1)氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
(2)在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .
A.萃取剂可选用苯、CCl4、裂化汽油等有机溶剂.
B.萃取分液时下层液体从下口放出,上层液体从上口倒出
C.在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
(3)通入热空气吹出溴,并用SO2的水溶液吸收的目的是 .
(4)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(5)步骤Ⅲ中有关反应的离子方程式 , 解释该反应能够发生的原因 .
(6)海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因 .
(7)工业上不用电解熔融MgO制金属镁,理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com