
����Ŀ����������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HClO | H2CO3 | H2SO3 |
����ƽ�ⳣ��(25 ��) | Ka��1.77 ��10��4 | Ka��4.0 ��10��8 | Ka1��4.3��10��7 Ka2��4.7��10��11 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
(1)���¶���ͬʱ���������Kaֵ�����Ե����ǿ���Ĺ�ϵΪ________________��
(2)��������0.1 mol��L��1 HCOONa����0.1 mol��L��1 NaClO����0.1 mol��L��1 Na2CO3����0.1 mol��L��1 NaHCO3��Һ��pH�ɴ�С�Ĺ�ϵΪ______________________��
(3)Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ�У�SO![]() ��CO
��CO![]() ��HSO
��HSO![]() ��HCO
��HCO![]() Ũ�ȴӴ�С��˳��Ϊ____________________________��
Ũ�ȴӴ�С��˳��Ϊ____________________________��
(4)�������ӷ���ʽ��ȷ����________(����ĸ)��
a��2ClO����H2O��CO2=2HClO��CO![]()
b��2HCOOH��CO![]() =2HCOO����H2O��CO2��
=2HCOO����H2O��CO2��
c��H2SO3��2HCOO��=2HCOOH��SO![]()
d��Cl2��H2O��2CO![]() =2HCO
=2HCO![]() ��Cl����ClO��
��Cl����ClO��
��5�������£�pH��3��HCOOH��Һ��pH��11��NaOH��Һ�������Ϻ���Һ������Ũ���ɴ�С��˳��Ϊ________________________��
���𰸡�(1)KaԽ������Խǿ(2)��>��>��>��
(3)c(SO32��)>c(CO32��)>c(HCO3��)>c(HSO3��)
(4)bd (5)c(HCOO��)>c(Na��)>c(H��)>c(OH��)
��������
�����������1�����¶���ͬʱ���볣��Խ������Խǿ��
��2���¶���ͬʱ���볣��Խ������Խǿ����Խ������Ӧ�����Խ����ˮ�⣬��Ӧ������Һ�ļ���Խǿ������ǿ��˳��ΪHCOOH��H2CO3��HClO��HCO3�����������������Һ��pH�ɴ�С�Ĺ�ϵΪ��>��>��>����
��3������ǿ��˳����H2SO3��H2CO3��HSO3����HCO3�������ˮ��̶���HSO3����HCO3����SO32����CO32��������Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ��SO32����CO32����HSO3����HCO3��Ũ�ȴӴ�С��˳��Ϊc(SO32��)>c(CO32��)>c(HCO3��)>c(HSO3��)��
��4��a��������������ǿ��̼���������ClO����H2O��CO2=HClO��HCO3����a����b������������ǿ��̼�ᣬ��2HCOOH��CO32��=2HCOO����H2O��CO2����b��ȷ��c������������ǿ���������������H2SO3��HCOO��=HCOOH��HSO3����c����d��������������ǿ��̼�������������̼�ᣬ��Cl2��H2O��2 CO32��=2 HCO3����Cl����ClO����d��ȷ����ѡbd��
��5�������£�pH��3��HCOOH��Һ��pH��11��NaOH��Һ�������Ϻ�������������Һ����������Һ������Ũ���ɴ�С��˳��Ϊc(HCOO��)>c(Na��)>c(H��)>c(OH��)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ��磬�����ڷǵ���ʵ��ǣ� ��
A. CH3CH2COOH B. Cl2 C. NH4HCO3 D. SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Դ�Ĺ���ԭ����ͼ������˵������ȷ����( )
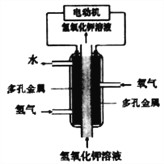
A. ���ö�������缫������缫�Ӵ��������߶��������������
B. ͨH2�ĵ缫������������������Ӧ
C. ͨO2�ĵ缫�����ĵ缫��Ӧ��O2+4e-+4H+=2H2O
D. �õ�ع���ʱ��������Ҫ����ת����ʽΪ��ѧ��ת��Ϊ���ܺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ղ������̵���CO��SO2������֮һ����һ�������½����ת��ΪCO2��S��
��֪����2CO(g)+O2(g)![]() 2CO2(g) H����566.0kJ/mol
2CO2(g) H����566.0kJ/mol
��S(g)+O2(g)![]() SO2(g) H����296.0kJ/mol
SO2(g) H����296.0kJ/mol
����˵������ȷ����
A. ת����������̼������Ȼ���Ԫ��ѭ��
B. ת������S��O2���ڲ�ͬ�ĺ���
C. ���ó����ʯ��ˮ����CO2��SO2
D. ת�����Ȼ�ѧ����ʽ�ǣ�2CO(g)+ SO2(g) ![]() S(s)+ 2CO2 (g) H ��+270kJ/mol
S(s)+ 2CO2 (g) H ��+270kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�ᡢ��ζ��ǵ����
B.����ʶ���������ˮ������
C.�����ﶼ�ǵ����
D.�⻯�ﶼ���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ŀ�������Դ��
��1����֪:2CH4(g)+O2(g) =2CO(g)+4H2(g) ��H=akJmol-1
CO(g) +2H2(g)=CH3OH(g) ��H=bkJmol-1
д����CH4��O2��ȡCH3OH(g)���Ȼ�ѧ����ʽ��____________________________��
��2����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ƽ�ⳣ��K�ı���ʽΪ________________����ͼ�Ƿ�ӦʱCO��CH3OH(g)�����ʵ���Ũ����ʱ�䣨t���ı仯���ߡ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����H2��ʾ�ķ�Ӧ������(H2)=________________��
CH3OH(g)��ƽ�ⳣ��K�ı���ʽΪ________________����ͼ�Ƿ�ӦʱCO��CH3OH(g)�����ʵ���Ũ����ʱ�䣨t���ı仯���ߡ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����H2��ʾ�ķ�Ӧ������(H2)=________________��
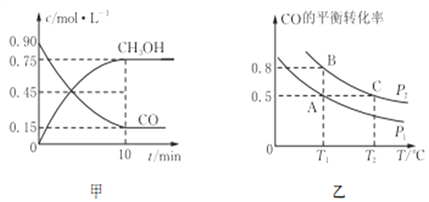
��3����һ�ݻ��ɱ���ܱ������г���10 mol CO��20 mol H2��������Ӧ���ﵽƽ�⣬CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯������ͼ����ʾ��
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______����ѡ����ĸ����
A��H2���������ʵ���CH3OH���������ʵ�2��
B��H2������������ٸı�
C��H2��ת���ʺ�CO��ת�������
D����������ƽ����Է����������ٸı�
�ڱȽ�A��B����ѹǿ��СP(A)________P(B)�����������=������
�۱Ƚ�KA��KB��KC�Ĵ�С��________________��
��4���Լ״�Ϊȼ�ϣ�O2Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫������KOH��Һ������д��ȼ�ϵ�ظ����ĵ缫��Ӧʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��12mLŨ��Ϊ0.05mol/L ��Na2SO3��Һǡ����VmLŨ��Ϊ0.02mol/L��K2X2O7��Һ��ȫ��Ӧ����֪XԪ���ڲ����еĻ��ϼ�Ϊ+3����VΪ�� ��
A. 5 B. 10 C. 15 D. 20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���ĸ�ʵ�鷽�������е���
A. ��ȥ����Cu���е�����Mg�ۺ�Al�ۣ���ϡ��������
B. �������ͺ�ú����������ȡ�ķ���
C. ��������غ��Ȼ��ƹ���Ļ��������ܽ⡢���˵ķ���
D. �������������Ļ������ͨ�����ȵ�����ͭ���Գ�ȥ���е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������������ֻ�������Ӽ�����______�����ڹ��ۻ��������____�������ڻ�ѧ������____��
��Ar ��CO2 ��Na2O2 ��H2SO4 ��NaCl ��NH4Cl ��CaO
��2��������Xn����N�����ӣ�X��������ΪA����ag X���⻯���к����ӵ����ʵ���Ϊ_________mol��
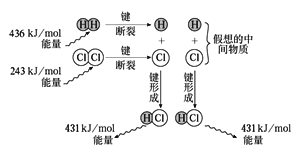
��3���۲���ͼ������1molH2��1molCl2��Ӧ�ͷŵ�����Ϊ______����������������ȼ�գ���Ӧ�����в�����ɫ�Ļ��棬�÷�Ӧ���γ�2 mol HClʱ�ͷŵ������������������ֵ���_______�����С������ȡ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com