
【题目】某溶液中存在XO3―,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+、H+、SO42-、I-
B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+
D.K+、SO42-、Cl-、CO32-
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。
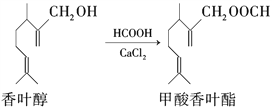
下列说法中正确的是( )
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 1mol甲酸香叶酯可以与2molH2发生加成反应
D. 甲酸香叶酯分子中所有碳原子均可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
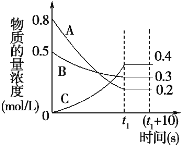
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )
A.1:1 B.2:1 C.3:2 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
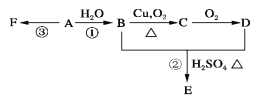
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:_____________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
____________________________________________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学──选修2:化学与技术】
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤;
d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。

(1)该反应为 热反应,原因是 。
(2)下列能说明该反应已经达到平衡状态的是 (填序号)
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。 达平衡时容器内平衡时与起始时的压强之比 。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式:
2H2(g)+O2(g)=2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)=2H2O(l) 放热Q2 kJ
H2(g)+1/2O2(g)=H2O(g) 放热Q3 kJ,其中Q1 Q2 Q3 大小关系是
A.Q1=Q2=Q3 B.2Q3=Q1<Q2
C.Q3<Q2<Q1 D.Q1<Q2<3Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com