
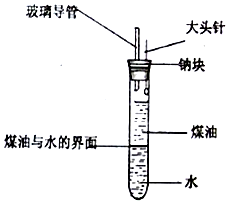
 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:分析 (1)实验开始时,欲使钠与水接触反应的操作是让钠与水接触开始反应,并观察现象、收集和验证产生的气体是否是氢气;
(2)钠密度小于水大于煤油;
(3)熔小球、浮水面说明本实验钠的物理性质有钠熔点低,密度比水小;
(4)设欲配制100mL0.100mol•L-1的BaCl2溶液,所需的0.1010mol•L-1的BaCl2溶液的体积为VmL,然后根据溶液稀释定律C浓V浓=C稀V稀来计算出所需的溶液的体积,然后用移液管移出一定体积的0.1010mol•L-1的BaCl2溶液,然后用胶头滴管向剩下的0.1010mol•L-1的BaCl2溶液中加水至刻度线,即可配制得0.100mol•L-1的BaCl2溶液.
解答 解:(1)接下来的操作是让钠与水接触开始反应,并观察现象、收集和验证产生的气体是否是氢气,应该按住橡皮塞,将大头针向上提,使钠块从针头脱落并落入水中,
故答案为:按住橡皮塞,将大头针向上抽,使钠块掉入水中;
(2)A.钠密度小于水大于煤油,钠在两液体界面处反应熔成小球并可能作上下跳动,故A错误;
B.钠密度小于水大于煤油,钠在两液体界面处反应熔成小球并可能作上下跳动,故B正确;
C.钠密度小于水大于煤油,钠在煤油和水层间反应熔成小球并上下跳动,故C错误;
D.钠和水反应生成氢氧化钠溶液和氢气,不断地减小至消失,故D正确;
E.钠在煤油和水层间反应熔成小球并上下跳动,故E错误;
F.钠和水反应生成的氢气不溶于水和煤油,煤油中有气泡产生,故F正确;
故答案为:B、D、F;
(3)熔小球、浮水面说明本实验钠的物理性质有钠熔点低,密度比水小,
故答案为:熔点低,密度比水小;
(4)设欲配制100mL0.100mol•L-1的BaCl2溶液,所需的0.1010mol•L-1的BaCl2溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
0.1010mol•L-1×VmL=100mL×0.100mol•L-1
解得V=99.01mL,故用1mL移液管移出0.99mL的0.1010mol•L-1的BaCl2溶液,然后用胶头滴管向剩下的99.01mL 0.1010mol•L-1的BaCl2溶液中加水至刻度线,即可配制得0.100mol•L-1的BaCl2溶液.
故答案为:用1mL移液管移出0.99mL的0.1010mol•L-1的BaCl2溶液,然后用胶头滴管向剩下的99.01mL 0.1010mol•L-1的BaCl2溶液中加水至刻度线,即可配制得0.100mol•L-1的BaCl2溶液.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉天平的使用方法,明确配制原理和操作过程是解题关键,注意误差分析的方法和技巧.本题考查钠与水反应的知识,主要是反应现象和原因,产物的实验验证,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量SO2的溶液中:NH4+、F-、HCO3-、ClO- | |
| B. | 能使淀粉碘化钾试纸变蓝的溶液:Cl-、Na+、S2-、NH4+ | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=10-13mol/L的溶液中:Al3+、Fe3+、NO3-、ClO4- | |
| D. | 滴入KSCN溶液显红色的溶液中:NO3+、Na+、AlO2-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池属于二次电池,在充电过程中,阳极质量减小,阴极质量增加 | |
| B. | 常温下,能自发进行的反应,△H一定小于“0” | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的活化能 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com