
已知2A2(g)+B2(g) 2C3(g) △H= -a kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H= -a kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________ b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列有关物质应用说法错误的是
A、小苏打可以做发酵粉
B、过氧化钠可用于呼吸面具或潜水艇中作为供氧剂
C、铁红常用作红色油漆或涂料
D、钠可以从硫酸铜溶液中置换出铜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:实验题
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
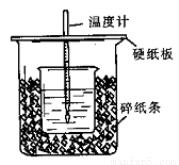
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”) 。
(6)写出NaOH溶液和盐酸反应表示中和热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。在25℃时,下列分析正确的是

A.使用该漂白剂的最佳pH为3
B.pH=5时,溶液中
C.pH=7时,溶液中含氯微粒的浓度大小为:
c(HClO2)>c( ClO2- )> c( ClO2) >c( Cl-)
D.NaClO2溶液加水稀释所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.室温下用广范pH试纸测得某氯水的pH=4
B .酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次
.酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次
C.若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高
D.酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上第一阶段测化学试卷(解析版) 题型:选择题
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
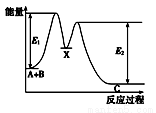
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列物质与水反应,能放出氧气的是
A.Na B. Na2O C. Na2O2 D.NO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:选择题
下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SiO2 |
B | HBr | NaOH | Na2CO3 | CaO |
C | CO2 | NH3·H2O | NaHCO3 | CuO |
D | CH3COOH | KOH | KCl | HClO3 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤
(1)用________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到
100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
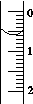
(3)读取盛装0.100 0 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______mL。
(4)滴定。当____________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积
V=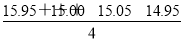 mL=15.24 mL
mL=15.24 mL
指出他的计算的不合理之处:______________________________________
按正确数据处理,可得c(市售白醋)=________mol/L;市售白醋总酸量________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com