
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
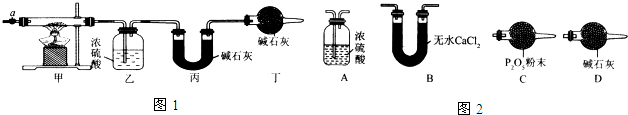
分析 (1)加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕;
(2)步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;
(3)在活塞a前,加装装置D,装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳.
(4)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,据此可以计算生成水的量;反应前丙装置的质量为62.00g,反应后质量为62.00g,据此计算产生二氧化碳的量,得到Co的质量和Co原子物质的量,根据Co、H、C元素守恒可知,来推导碱式碳酸钴的化学式;
(5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃为蓝色,可以滤去黄光的干扰;
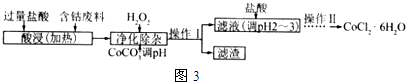
(6)向含钴废料中加入过量稀盐酸,Fe、Al和稀盐酸反应生成FeCl2、AlCl3、CoCl2,向溶液中加入双氧水和CoCO3,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,加入CoCO3,调节溶液的pH至7.6,使Fe(OH)3、Al(OH)3生成沉淀,然后过滤,滤渣为Fe(OH)3、Al(OH)3,滤液中含有CoCl2,然后向滤液中加入稀盐酸,抑制CoCl2水解,然后采用蒸发浓缩、冷却结晶和过滤方法得到CoCl2•6H2O;
①双氧水具有氧化性,能氧化还原性离子;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3;
③CoCl2为强酸弱碱盐,阳离子水解导致溶液呈酸性,加入稀盐酸能抑制水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
解答 解:(1)加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,故答案为:不再有气泡产生;
(2)步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果.
故答案为:将装置中生成的CO2和H2O全部排入乙、丙装置中;
(3)在活塞a前,加装装置D,装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳.
故答案为:D、活塞a前;
(4)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,故生成水的质量为80.36g-80.00g=0.36g,物质的量为$\frac{0.36g}{18g/mol}$=0.02mol;反应前丙装置的质量为62.00g,反应后质量为62.00g,生成二氧化碳的质量为62.88g-62.00g=0.88g,物质的量为$\frac{0.88g}{44g/mol}$=0.02mol,故Co的质量为3.65g-0.02mol×2×17g/mol-0.02mol×60g/mol=1.77g,故Co原子物质的量为:$\frac{1.77g}{59g/mol}$=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2.故答案为:Co3(OH)4(CO3)2.
(5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃为蓝色,可以滤去黄光的干扰.
故答案为:蓝色;
(6)向含钴废料中加入过量稀盐酸,Fe、Al和稀盐酸反应生成FeCl2、AlCl3、CoCl2,向溶液中加入双氧水和CoCO3,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,加入CoCO3,调节溶液的pH至7.6,使Fe(OH)3、Al(OH)3生成沉淀,然后过滤,滤渣为Fe(OH)3、Al(OH)3,滤液中含有CoCl2,然后向滤液中加入稀盐酸,抑制CoCl2水解,然后采用蒸发浓缩、冷却结晶和过滤方法得到CoCl2•6H2O;
①双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
③CoCl2为强酸弱碱盐,阳离子水解导致溶液呈酸性,加入稀盐酸能抑制水解,所以加入稀盐酸的目的是抑制CoCl2水解,故答案为:抑制CoCl2水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤,故答案为:冷却结晶.
点评 本题考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
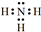 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
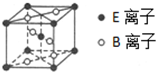 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
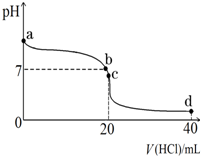 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com