
| m |
| M |
| n |
| V |
| 46.6g |
| 233g/mol |
| 59.1g |
| 197g/mol |
| 0.2mol |
| 0.5L |
| 0.3mol |
| 0.5L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、64g氧气中含氧分子数为2NA |
| B、1.7gOH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
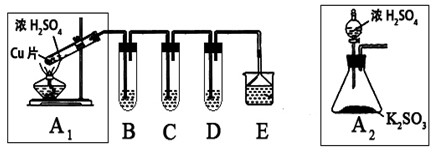
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 选项的标号 |
| 除去FeCl2溶液中的少量FeCl3 | |
| 除去FeCl3溶液中的少量FeCl2 | |
| 除去SiO2中Al2O3 | |
| 除去Fe2O3中Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
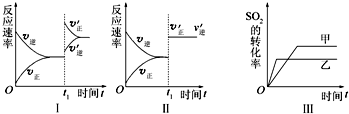
| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |
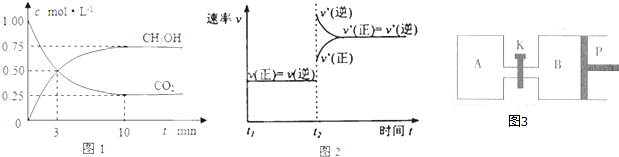
查看答案和解析>>
科目:高中化学 来源: 题型:
| 9a+b |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com