
(1)Ca(OH)2====Ca2++(OH)2-应改为:
________________________________________________________。
(2)FeCl2====Fe2++3Cl-应改为:
________________________________________________________。
(3)Al2(SO4)3====2Al3++![]() 应改为:
应改为:
________________________________________________________。
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)=c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源:2010年广西柳铁一中高三上学期第二次月考(理综)化学 题型:实验题
(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
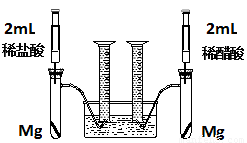
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB-
HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
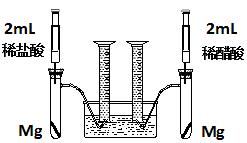
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB-![]() H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:实验题
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
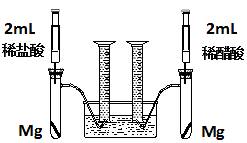 实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是
。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com