
 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
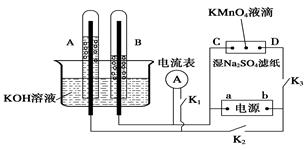
 aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )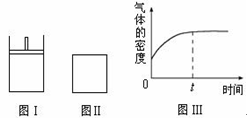
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3△H<0,制备硫酸,下列对该反应的说法正确的是
2SO3△H<0,制备硫酸,下列对该反应的说法正确的是| A.增大压强,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 |
| D.当单位时间内生成2 mol SO2的同时生成2 mol SO3,说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是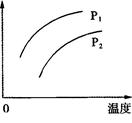
| A.若P1>P2,纵坐标表示A的质量分数 |
| B.若P1<P2,纵坐标表示C的质量分数 |
| C.若P1>P2,纵坐标表示混合气体的平均摩尔质量 |
| D.若P1<P2,纵坐标表示A的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 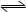 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 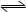 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 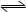 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 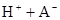 |  | 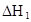 |  |
在苯中,2HA 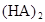 | 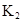 | 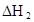 | 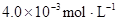 |
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则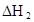 ___________0。
___________0。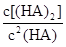 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是
xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是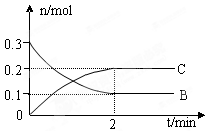
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
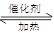 2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D.该反应过程中转移了2mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 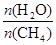 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: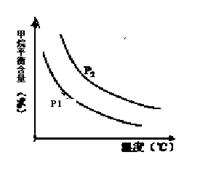
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com