(14分)(Ⅰ)FeCl3的水溶液呈________(填“酸性”、“碱性”或“中性”),原因是__________________________________(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以___________(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如右图所示,其读数为 mL。

(2)根据下列数据:
滴定次数
| 待测液体积(mL)
| 标准盐酸体积(mL)
|
滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 20.00
| 0.50
| 25.40
|
第二次
| 20.00
| 4.00
| 29.10
|
请计算待测烧碱溶液的浓度为
mol/L。
(3)下列实验操作会使实验结果偏高的是
。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡


 每课必练系列答案
每课必练系列答案


 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式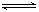 HSO3-+OH-
HSO3-+OH-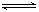 HSO3-+OH-
HSO3-+OH-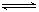 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是 Fe(OH)3胶体+3HCl
Fe(OH)3胶体+3HCl Fe(OH)3胶体+3HCl
Fe(OH)3胶体+3HCl