
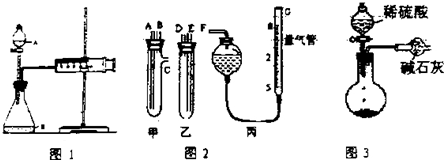
分析 (1)根据速率的表达式v=$\frac{△c}{△t}$判断需要测量数据;使装置内外形成气压差是气密性检查的常用手段;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸;
②图中量气装置和碱式滴定管相似;
③连接导管时,应用A连接D,B连接E,C连接F;
④读数时应使丙装置内外气压相等,故读数前应使左右两边液面相平;滴定管内测量前后溶液体积变化为气体体积,俯视时,读取的液面的数值比实际偏小变.
丙同学的实验中:根据碱石灰的成分可知,碱石灰既可吸收二氧化碳也可吸收水,以及干燥管与空气接触等进行分析即可.
解答 解:(1)根据速率的表达式v=$\frac{△c}{△t}$判断需要测量数据,通过分液漏斗加入1mol•L-1稀硫酸40mL,收集10mL气体可计算硫酸浓度变化,故还需知道反应时间;使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好,
故答案为:反应时间;关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)①由图装置可知甲有c支管,应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸,
故答案为:甲;乙;
②G为量气装置,根据构造,可用碱式滴定管代替,
故答案为:碱式滴定管;
③连接导管时,应用A连接D,B连接E,C连接F,
故答案为:D、E、F;
④读数时应装置内外气压相等,读数前应上下移动滴定管,使左右两边液面相平;俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大,
故答案为:上下移动滴定管,使左右两边液面相平;偏大;
丙同学的实验中:因生产的CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,会导致质量偏大,
故答案为:CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中.
点评 本题考查物质的含量测定的实验设计,侧重于考查学生分析能力和实验能力,题目较为综合,为高考常见题型,注意把握实验原理和操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯与溴水 | B. | 乙酸钠溶液与硫酸 | ||
| C. | 甲苯与KMnO4酸性溶液 | D. | 甲酸溶液与银氨溶液水浴共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| B. | 浓盐酸与KMnO4制氯气的离子方程式是:MnO4-+8H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+4H2O | |
| C. | 漂白粉溶液在空气中失效变化的离子方程式是:ClO-+CO2+H2O=HClO+HCO3- | |
| D. | H2O2具有很强的氧化性,在化学反应中只能作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
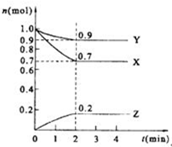 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都能与金属钠反应 | |
| B. | 用氢氧化钠除去乙酸乙酯中的少量乙酸 | |
| C. | 植物油和动物脂肪都不能使溴水褪色 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 2 g 氢气所含原子数目为 NA | |
| C. | 在常温常压下,11.2 L 氮气所含的原子数目为 NA | |
| D. | 17 g 氨气所含电子数目为 10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
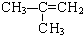 互为同分异构体,关于它们的性质叙述正确的是( )
互为同分异构体,关于它们的性质叙述正确的是( )| A. | 它们的分子式相同,物理性质相同 | |
| B. | 它们都具有碳碳双键,与H2加成的产物完全相同 | |
| C. | 它们都能使酸性高锰酸钾溶液褪色 | |
| D. | 它们都符合通式CnH2n-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | SO3→H2SO4 | C. | NO→HNO3 | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com