
分析 (1)稀硝酸与铜反应生成硝酸铜、NO气体和水;反应结束再加稀硫酸,Cu与氢离子、硝酸根离子反应生成铜离子、NO和水;
(2)Cu与稀硫酸不反应;
①若X为双氧水,Cu与双氧水、稀硫酸反应生成硫酸铜、水;
②若X为FeCl3,FeCl3与Cu反应生成FeCl2和CuCl2;
③若X为NaNO3,Cu与氢离子、硝酸根离子反应生成铜离子、NO和水.
解答 解:(1)稀硝酸与铜反应生成硝酸铜、NO气体和水,所以反应现象为铜片减少,有无色气体生成,溶液变蓝色;反应结束再加稀硫酸,Cu与氢离子、硝酸根离子反应生成铜离子、NO和水,其反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:铜片减少,有无色气体生成,溶液变蓝色;又有无色气体生成;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)Cu与稀硫酸不反应,所以少量铜片加入稀硫酸中,没有明显现象;
故答案为:没有明显现象;
①若X为双氧水,Cu与双氧水、稀硫酸反应生成硫酸铜、水,Cu逐渐溶解,溶液变蓝色,其反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
故答案为:Cu逐渐溶解,溶液变蓝色;Cu+H2O2+2H+=Cu2++2H2O;
②若X为FeCl3,FeCl3与Cu反应生成FeCl2和CuCl2,Cu逐渐溶解,溶液变蓝色,其反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+;
故答案为:Cu逐渐溶解,溶液变蓝色;Cu+2Fe3+=Cu2++2Fe2+;
③若X为NaNO3,Cu与氢离子、硝酸根离子反应生成铜离子、NO和水,Cu逐渐溶解,溶液变蓝色,有无色气体生成,其反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:Cu逐渐溶解,溶液变蓝色,有无色气体生成;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查了Cu及硝酸的性质、离子方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48 L N2和O2的混合气体中所含原子数为0.4NA | |
| B. | 常温下,1.0 L 1.0 mol•L-1NaAlO2溶液中含有的氧原子数为2NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
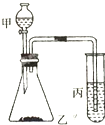 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
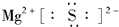 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
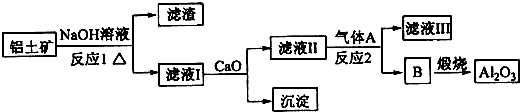
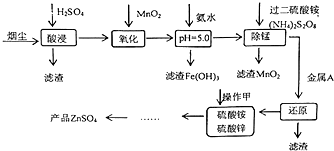 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NH3)=0.6mol/(L•S) | B. | V(O2)=0.7mol/(L•S) | C. | V(NO)=0.5mol/(L•S) | D. | V(H2O)=0.8mol/(L•S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com