
下列有关热化学方程式的叙述正确的是( )
|
| A. | 2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
|
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol |
|
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2.则△H1>△H2 |
考点:
反应热和焓变.
专题:
化学反应中的能量变化.
分析:
A、依据燃烧热概念分析,燃烧热指1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、物质能量越高越活泼;
C、依据酸碱中和热概念是强酸强碱稀溶液反应生成1mol水放出的热量计算分析;
D、一氧化碳燃烧生成二氧化碳放热分析.
解答:
解:A、依据燃烧热概念分析,燃烧热指1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,生成的水不是稳定氧化物,则氢气的燃烧热大于241.8kJ,故A错误;
B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨能量高,物质能量越高越活泼,金刚石稳定性小于石墨,故B错误;
C、依据酸碱中和热概念是强酸强碱稀溶液反应生成1mol水放出的热量计算分析,含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,40g氢氧化钠完全反应放热57.4 kJ,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol,故C正确;
D、一氧化碳燃烧生成二氧化碳放热,焓变为负值比较大小,2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2,故D错误;
故选C.
点评:
本题考查了燃烧热、中和热概念分析计算应用,盖斯定律实质理解判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:
2003年“非典”曾在我国流行,民间都用过氧乙酸(CH3COOOH)作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢.有关过氧乙酸的叙述不正确的是()
A. 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B. 过氧乙酸因具有强氧化性,所以有杀菌作用
C. 在使用过氧乙酸消毒时浓度不是越大越好
D. 过氧乙酸与苯酚混合使用杀菌能力更强
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH﹣离子浓度分别为Amol•L﹣1与Bmol•L﹣1,则A和B的关系为( )
|
| A. | A>B | B. | A=10﹣4B | C. | B=10﹣4A | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:
在理论上不能用于设计原电池的化学反应是( )
|
| A. | 2FeCl3(aq)+2KI(aq)═2FeCl2(aq)+2KCl(aq)+I2(aq)△H<0 |
|
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq)+8H2O(l)△H>0 |
|
| C. | 4Al(s)+6H2O(l)+3O2(g)═4Al(OH)3(s)△H<0 |
|
| D. | Zn(s)+2MnO2(s)+2H2O(l)═2MnOOH(s)+Zn(OH)2(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年曾经建议,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
|
| A. | 第15列元素的最高价氧化物为R2O5 |
|
| B. | 第2列元素中肯定没有非金属元素 |
|
| C. | 第17列元素的第一种元素无含氧酸 |
|
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
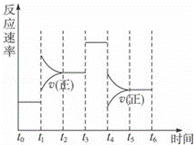
在一密闭体系中发生下列反应A(g)+3B(g)⇌2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是: 、 、 ;
(2)C体积分数最高的时间段是 .(填“tx﹣ty”)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为()
A. v(NH3)=0.01 mol•L﹣1•s﹣1 B. v(O2)=0.001 mol•L﹣1•s﹣1
C. v(NO)=0.001 mol•L﹣1•s﹣1 D. v(H2O)=0.045 mol•L﹣1•s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H<0,在其他条件不变的情况下()
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com