
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
分析 A.二氧化碳过量,反应生成碳酸氢钠;
B.二氧化碳过量,反应生成碳酸氢钙;
C.氢氧化钡过量,反应生成硫酸钡、氢氧化钠和水;
D.二者反应生成碳酸钙和水.
解答 解:A.氢氧化钠溶液中通入过量CO2,离子方程式:CO2+OH-═HCO3-,故A错误;
B.向澄清石灰水中通入过量CO2,离子方程式:CO2+OH-═HCO3-,故B错误;
C.硫酸氢钠溶液中加入过量氢氧化钡溶液,离子方程式:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C错误;
D.向碳酸氢钙溶液中加入过量石灰水,离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查反应物用量对反应的影响,明确反应实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Zn+HNO3(浓)--Zn(NO3)2+NO2↑+H2O | B. | Zn+HNO3(浓)--Zn(NO3)2+NO↑+H2O | ||
| C. | Zn+HNO3(很稀)--Zn(NO3)2+NO2↑+H2O | D. | Zn+HNO3(很稀)--Zn(NO3)2+NH4NO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
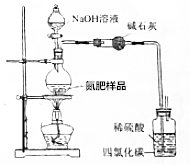 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3 | B. | NaHSO3 | C. | Na2SO3和NaHSO3 | D. | NaOH和Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com