广东省拥有丰富的海洋资源,盐化工是广东省的主要产业之一.从盐卤初步得到的光卤石(KCl?MgCl
2?6H
2O)晶体中,还含有约8%的NaCl.
为了从光卤石中提取KCl和MgCl
2,某学习小组查阅资料得到MgCl
2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:

并设计出下面的实验流程:

根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为
KCl
KCl
,若制得的X还含有少量的可溶性杂质,可用
重结晶
重结晶
的方法进一步提纯.操作步骤①中为趁热过滤的原因是
防止氯化镁析出
防止氯化镁析出
.
问题2:工业上采用电解无水氯化镁的方法制取金属镁.
(1)若在空气中加热MgCl
2?6H
2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
MgCl2?6H2O═Mg(OH)Cl+HCl↑+5H2O↑
MgCl2?6H2O═Mg(OH)Cl+HCl↑+5H2O↑
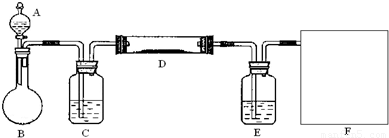
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl
2?6H
2O来得到无水MgCl
2.装置中盛有浓硫酸的仪器分别是
A、C、E
A、C、E
(填写仪器的符号),需要加热的仪器是
D
D
(同上).
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳.请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂.





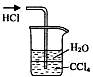 ,故答案为:
,故答案为: .
.

 名校课堂系列答案
名校课堂系列答案