
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:阅读理解

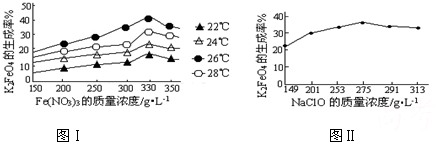
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:022
在NaNO3、KOH、CH4、MgO、CH3COOH、CaF2、N2中,属于离子化合物的是________,属于共价化合物的是________,含有离子键的有________,含有共价健的有________.
查看答案和解析>>
科目:高中化学 来源:2010年重庆理科测试模拟试卷(一)化学部分 题型:实验题
(15分)
实验室通过实验测定NaOH溶液和盐酸反应的中和热.实验需用约450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一个)
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在 (填实验用品或仪器的名称),用托盘天平 g NaOH固体.在使用容量瓶前必须进行的操作是 .
(2)下列操作会使所配溶液的浓度偏高的是(填序号) .
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线.
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是 . 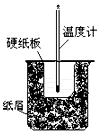
(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为 .
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为 (填字母).
A.a>b>c B.b>c>a C.a="b=c " D.无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com