
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
分析 陶瓷是利用黏土在高温条件下烧制,得结构致密的多晶烧结体.其生产过程中发生复杂的化学变化和物理变化;玻璃是硅酸盐,工业上用石灰石、纯碱、石英在玻璃熔炉中熔融制得,生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥.据此分析.
解答 解:硅酸盐指的是硅、氧与其它化学元素结合而成的化合物的总称,陶瓷、玻璃、水泥等都是硅酸盐产品.
生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,所以在玻璃工业、水泥工业中都用到的原料是石灰石;
生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;
①生产水泥以黏土和石灰石为主要原料,黏土中含硅,生产玻璃的原料是纯碱、石灰石和石英,石英中含有硅,故正确;
②玻璃主要成分是硅酸钠、硅酸钙、二氧化硅等属于硅酸盐产品,普通水泥主要成分:硅酸三钙、硅酸二钙、铝酸三钙等都是硅酸盐产品,故正确;
③生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,生产玻璃的原料是纯碱、石灰石和石英,高温下进行,所以反应条件都是高温,故正确;
④水泥和玻璃的生产,反应原理都是一系列复杂的物理化学变化,故正确;
故选C.
点评 本题考查玻璃和水泥的成分、原料等,题目难度不大,明确发生的反应是解题的关键.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:填空题

 ;C分子中的官能团有醚键和溴原子.(填名称)
;C分子中的官能团有醚键和溴原子.(填名称) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | BaO2是离子化合物,但含有非极性共价键,晶体中阴阳离子个数相等. | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | 电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| B. | 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水 | |
| C. | 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含CO32-或HCO3- | |
| D. | 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b端是直流电源的负极 | |
| B. | 实验过程中溶液的导电能力没有明显变化 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
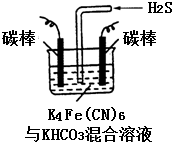 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com