
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. 在0.1 mol·L-1 BA溶液中c(A-)+c(H+)=c(BOH) +c(OH-)
B. 若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9
C. 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)> c(B+)
D. 若将上述两溶液按体积比1: 2混合,则混合液中: c(B+) > c(A-) > c(BOH) > c(OH-) > c(H+)
【知识点】离子浓度大小的比较 弱电解质的电离 H1 H6
【答案解析】D 解析:0.1mol/LHA溶液的PH=1,说明HA完全电离,为强电解质,0.1mol/L的BOH溶液的pH=11,说明碱不完全电离,为弱电解质,
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(B+)+c(H+)=c(A-)+c(OH-),根据物料守恒得c(BOH)+c(B+)=c(A‑),则c(H+)=c(BOH)+c(OH-),故A错误;
B.弱电解质BOH溶液中存在电离平衡,加水稀释促进BOH电离,所以将0.1mol•L-1BOH溶液稀释至0.OO1mol•L-1则溶液的pH>9,故B错误;
C.混合溶液pH=7,则溶液中c(OH-)=c(H+),溶液中存在电荷守恒c(B+)+c(H+)=c(A-)+c(OH-),所以得c(A-)=c(B+),故C错误;
D.将上述两溶液按体积比1:2混合,则两种溶液中溶质为BA和BOH,BOH的电离程度大于B+水解程度,所以溶液呈碱性,则c(OH-)>c(H+)、c(B+)>c(A-),溶液中BOH浓度大于c(OH-),所以离子浓度大小顺序是c(B+)>c(A-)>c(BOH)>c(OH-)>c(H+),故D正确;故答案选D
【思路点拨】本题考查了离子浓度大小的比较,先根据酸碱浓度及溶液pH确定酸碱强弱,再结合电荷守恒、物料守恒解答。


科目:高中化学 来源: 题型:
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_________________________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是
。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于密闭容器中的可逆反应:mX(g)+nY(s)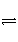
 pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下图曲线a表示放热反应X(g)+Y(g)Z(g)+M(g)+N(s)进行过程中,X的转化率随时间t变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采用的措施是( )

A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中投入一定量的A和B发生反应:
mA(g)+nB(g)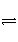
 pC(g)+qD(g)。
pC(g)+qD(g)。

(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温、恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温、恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Al(OH)3的电离方程式为:AlO2-+H++H2O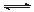 Al(OH)3
Al(OH)3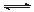 Al3++3OH-
Al3++3OH-
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是 ( )
A.均为强电解质 B.均为弱电解质 C.均为离子化合物 D.均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列有关电解质溶液的叙述正确的是 ( )
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液
B.能自发进行的化学反应,一定是 H<0、
H<0、 S>0
S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)下列说法正确的是______(填序号)。
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应为2H++2e-===H2↑和4OH--4e-===2H2O+O2↑
C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1
D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化
(2)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的pH为______。
(3)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为______mol。
(4)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com