
 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:分析 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大.X的核外电子总数与其周期数相同,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;Q的最外层电子数为2,其他电子层电子均处于饱和状态,只能是第四周期的过渡元素,核外电子排布为1s22s22p63s23p63d104s2,则Q为Zn元素;R与Y同一主族,结合原子序数可知,R为Si,而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期,第一电离能比Z的低,则W为O元素,据此解答.
解答 解:前四周期元素X、Y、Z、W、R、Q的原子序数依次增大.X的核外电子总数与其周期数相同,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;Q的最外层电子数为2,其他电子层电子均处于饱和状态,只能是第四周期的过渡元素,核外电子排布为1s22s22p63s23p63d104s2,则Q为Zn元素;R与Y同一主族,结合原子序数可知,R为Si,而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期,第一电离能比Z的低,则W为O元素.
(1)R为Si,核外电子排布式为:1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)X、Y、Z、W形成的有机物CO(NH2)2中碳原子杂化轨道数目为3,采取sp2杂化,N原子杂化轨道数目为3=1=4,N原子采取sp3杂化,NO3-离子中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,故其立体构型是平面三角形,
故答案为:sp2、sp3;平面三角形;
(3)配合物[Zn(NH3)4]Cl2中锌离子与氨气分子之间形成4个配位键,每个氨气分子中形成3个N-H键,
故1mol该配合物中含有16molσ键,即σ键的数目为16NA,
故答案为:16NA;
(4)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是 SiO2,
故答案为:SiO2; SiO2为原子晶体,CO2为分子晶体;
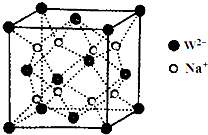
(5)Na+处于晶胞内部,晶胞中Na+离子数目为8,O2-处于晶胞顶点与面心,晶胞中O2-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该离子化合物为Na2O,
由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,8个钠离子构成的几何体为:立方体,
面心O2-离子与顶点O2-离子距离最近,晶胞质量为$\frac{4×62}{{N}_{A}}$g,该晶胞的密度为ρg•cm-3,而晶胞体积为$\frac{4×62}{{N}_{A}}$g÷ρg•cm-3=$\frac{248}{ρ{N}_{A}}$cm3,晶胞棱长为$\root{3}{\frac{248}{ρ{N}_{A}}}$cm,则两个最近的W离子间距离为$\root{3}{\frac{248}{ρ{N}_{A}}}$cm×$\frac{\sqrt{2}}{2}$=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{248}{ρ{N}_{A}}}$cm=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{248}{ρ{N}_{A}}}$×10-2m,
故答案为:Na2O;4;立方体;$\frac{\sqrt{2}}{2}$$\root{3}{\frac{248}{ρ{N}_{A}}}$×10-2.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、晶体类型与性质、化学键、晶胞结构与计算等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ②⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱NaOH,食盐NaCl | B. | 小苏打Na2CO3,苛性钠NaOH | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 芒硝Na2SO4•10H2O,消石灰Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
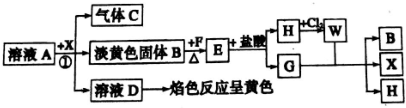
 ,G中化学键的类型为极性共价键;
,G中化学键的类型为极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 g | B. | 0.54 g | C. | 0.5 g | D. | 0.35 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③④ | C. | ①②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com