
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO![]() 、SO
、SO![]() 、Na+
、Na+
B. 由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO![]()
C. c(H+)/c(OH-)=1012的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
【答案】C
【解析】试题分析:A、因pH=1的溶液有大量H+,则H+、Fe2+、NO3-发生氧化还原反应,则不能大量共存,故A错误;B、因水电离的c(H+)=1×10-14molL-1<1×10-7molL-1,抑制了水的电离,则溶液可能为酸或碱的溶液,HCO3-既与H+反应又能与OH-反应,则一定不能大量共存,故B错误;C、由c(H+)/c(OH-)=1012的溶液,则c(H+)=1×10-1molL-1,在酸性条件下该组离子不反应,则能大量共存,故C正确;D、因Fe3+与SCN-结合生成络合物Fe(SCN)3,且Fe3+与ClO-发生双水解反应,则不能大量共存,故D错误;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是( )
A.饱和碳酸钠溶液B.饱和 NaOH溶液C.饱和食盐水D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是 ( )
xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是 ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质属于电解质的是______;能导电的是_____;属于弱电解质的是______(均填写序号)。
①醋酸溶液②乙醇③胆矾④熔融氯化钠⑤二氧化硫⑥氨水⑦硫酸钡⑧蔗糖⑨氢氧化铁⑩浓盐酸
(2)Cl2通入一定浓度NaOH溶液后生成了三种含氯化合物,其中n(NaClO):n(NaClO3)= 5:1,写出Cl2与NaOH溶液反应的化学方程式并用双线桥表示出电子转移的方向和数目:_________。
(3)标准状况下4.48LCO2溶于100mL3.0mol/LNaOH溶液,所得产物成分是_____,物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式为 ,下列关于分枝酸的说法不正确的是
,下列关于分枝酸的说法不正确的是
A. 分子中含有3种含氧官能团
B. 1 mol分枝酸最多可与3mol NaOH发生中和反应
C. 在一定条件下可与乙醇、乙酸反应,且反应类型相同
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液退色,但退色原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的作用,下列叙述正确的是
A. 氧化铝的熔点很低,不能用于制作耐高温材料
B. 光化学烟雾与氮氧化合物有关
C. 无水乙醇用作医用消毒剂效果更好
D. Na、S、C分别在氧气中燃烧均可得到两种不同的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸和亚硝酸盐在生产、医药等领域有着广泛应用。某校化学兴趣小组用下图所示仪器(夹持装置已省略)及药品,探究硫酸与亚硝酸钠反应生成气体的成分。已知NO2和NO液化温度分别为21 ℃和-152 ℃。
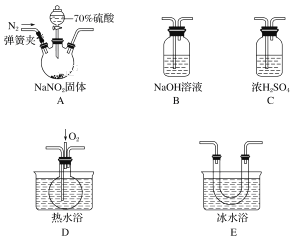
(1)A中盛放70%硫酸的仪器名称为___________________,反应前通入氮气的目的是_______________________________________________;仪器的连接顺序(按左→右连接)为A→________→________→________→B;
(2)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体含有NO,依据的现象是__________________________________;
(3)装置A中反应的化学方程式为________________________________;
(4)如果没有装置C,对实验结论造成的影响是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅改变下列一个条件,能通过提高活化分子的百分率来提高反应速率的是( )
①加热 ②加压 ③加催化剂 ④增大反应物浓度
A.①④B.②④C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com