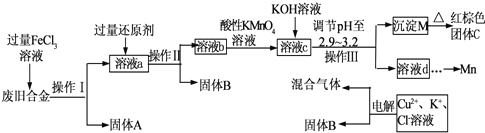
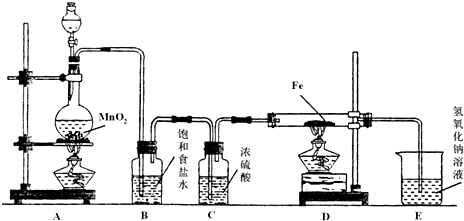
解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O
,注意稀盐酸和二氧化锰不反应.
故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O;
(2)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应饱和食盐水;浓硫酸常常干燥能和碱反应气体,故选浓硫酸.
故答案为:除去HCl; 吸收水蒸气;
(3)实验开始需要先生成氯气充满装置后,再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,反应的离子方程式为:2Fe+3Cl
2=2FeCl
3;尾气吸收需要用氢氧化钠溶液吸收氯气,反应的离子方程式为,Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
故答案为:A; D;2Fe+3Cl
2=2FeCl
3; Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;若实验中用12mol?L
-1浓盐酸10mL与足量的MnO
2反应,生成Cl
2的物质的量总是小于0.03mol,原因是HCl挥发,浓盐酸变稀不再反应;欲使反应生成Cl
2的物质的量最大程度的接近0.03mol,反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
故答案为:HCl挥发,浓盐酸变稀不再反应;慢慢滴加浓盐酸,缓缓加热;
分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;
(2)根据氯化氢和氯气的性质分析选用除杂试剂;浓硫酸常常干燥能和碱反应气体;
(3)先生成氯气充满装置后再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,尾气吸收需要用氢氧化钠溶液吸收氯气;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
点评:本题考查了氯气的实验室制法及化学性质,难度不大,氯气的氧化性、二价铁离子和三价铁离子的检验是高考的热点,注意方向反应过程的量的变化,题目难度中等.

 某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验. MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O  MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;