
分析 (1)水溶液中或者熔融状态下能够导电的化合物是电解质,水溶液中和熔融状态下都不能够导电的化合物是非电解质;
(2)氯化氢是强酸,为强电解质,完全电离;
氢氧化钡为强碱,是强电解质,完全电离;
硫酸铜为盐,是强电解质,完全电离.
解答 解:(1)①食盐水是混合物,既不是电解质也不是非电解质;
②氯气,为单质,既不是电解质也不是非电解质;
③CO2本身不能电离出自由移动的离子,属于非电解质;
④NaOH水溶液中或者熔融状态下能够导电是电解质;
⑤酒精水溶液中和熔融状态下都不能够导,是非电解质;
⑥铜是单质,既不是电解质也不是非电解质;
⑦Al2O3熔融状态下能够导电,是电解质;
所以属于电解质的是④⑦,属于非电解质的是②⑧;
故答案为:④⑦;②⑧;
(2)①氯化氢是强酸,为强电解质,完全电离,电离方程式:HCl=H++Cl-;
故答案为:HCl=H++Cl-;
②氢氧化钡为强碱,是强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
故答案为:Ba(OH)2=Ba2++2OH-;
③硫酸铜为盐,是强电解质,完全电离,电离方程式:CuSO4=Cu2++SO42-;
故答案为:CuSO4=Cu2++SO42-.
点评 本题考查了电解质、非电解质判断,电离方程式的书写,明确电解质、非电解质概念,熟悉常见的强电解质、弱电解质及电离方式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2υ(AB)=υ(A2) | |
| B. | 容器内三种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内消耗n mol A2,同时消耗n mol AB |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
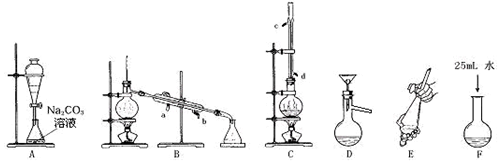
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
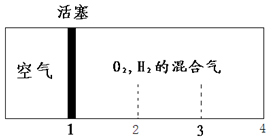 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )| A. | 7:2 | B. | 5:4 | C. | 3:1 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
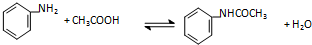
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com