
化学实验有助于理解化学知识,提升科学素养。某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究。
(1)已知发生装置如图所示。制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)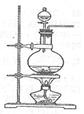
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸。
(2)该小组关于实验中可制得氯气体积(标准状况)的讨论正确的是
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有________ (填微粒符号)
(4)下列收集Cl2的正确装置是________。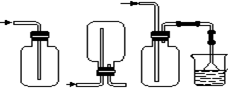
A B C D
(5)该小组利用刚吸收过少量SO2的NaOH溶液对Cl2进行尾气处理。
①请完成吸收初期的化学方程式:Cl2+Na2SO3+2 NaOH= ________________
②吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收后的溶液中存在 (填微粒符号),用离子方程式表示蓝色褪去的可能原因: 。
(1)A C B (2)C (3)Cl2、ClO- 、 HClO (4)C
(5)①2NaCl+Na2SO4+H2O ②ClO- ; I2+2OH-=I-+IO-+H2O
解析试题分析:(1)在实验室制取Cl2时首先应该检查装置的气密性。然后再往烧瓶中加入MnO2粉末;接着往烧瓶中加入浓盐酸最后加热;顺序是A.C.B。发生反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。A.若提供0.4 mol HCl,MnO2不足量,应该以不足量的物质为标准,但是MnO2的量不定,因此产生的氯气在标准状况下的体积一定小于2.24 L。错误。 B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L则如果0.4 mol HCl完全反应,可制得氯气2.24 L。但是随着反应的进行,盐酸变为稀盐酸,这时反应就不再发生。因此制得氯气在标准状况下的体积就小于2.24 L。错误。C.根据方程式可以看出:每有4mol的盐酸发生反应,产生标准状况下的氯气的体积为22.4L。因此若有0.4 mol HCl参与反应,则可制得氯气2.24 L。正确。D.由方程式可以看出:每有4mol的盐酸发生反应,则有2mol的盐酸贝氧化,得到氯气为1mol。因此若有0.4 mol HCl被氧化,则可制得标准状况下的氯气4.48 L.错误。(3)将Cl2通入水中,发生反应:Cl2+H2O
MnCl2+Cl2↑+2H2O。A.若提供0.4 mol HCl,MnO2不足量,应该以不足量的物质为标准,但是MnO2的量不定,因此产生的氯气在标准状况下的体积一定小于2.24 L。错误。 B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L则如果0.4 mol HCl完全反应,可制得氯气2.24 L。但是随着反应的进行,盐酸变为稀盐酸,这时反应就不再发生。因此制得氯气在标准状况下的体积就小于2.24 L。错误。C.根据方程式可以看出:每有4mol的盐酸发生反应,产生标准状况下的氯气的体积为22.4L。因此若有0.4 mol HCl参与反应,则可制得氯气2.24 L。正确。D.由方程式可以看出:每有4mol的盐酸发生反应,则有2mol的盐酸贝氧化,得到氯气为1mol。因此若有0.4 mol HCl被氧化,则可制得标准状况下的氯气4.48 L.错误。(3)将Cl2通入水中,发生反应:Cl2+H2O H++Cl-+HClO。HClO是弱酸,在溶液中存在电离平衡:HClO
H++Cl-+HClO。HClO是弱酸,在溶液中存在电离平衡:HClO H++ClO-.在所得溶液中具有氧化性的含氯粒子有Cl2、ClO-、HClO。(4)A只有入气管,而没有出气管。错误。B.Cl2的密度比空气大,要用向上排空气法收集。错误。C.是用用向上排空气法收集,由于Cl2是大气污染物,所以在排放之前进行了尾气的吸收和处理。正确。D不能收集气体。氯气被处理吸收。错误。选项为C。(5)①Cl2有氧化性,Na2SO3有还原性,二者发生反应的化学方程式:Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。②吸收一段时间后,向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,是因为溶液中发生了反应:Cl2+2OH-=Cl-+ClO-+H2O。ClO-有强氧化性,能把I-氧化为I2。I2遇淀粉变为蓝色。随即又褪去,是因为又发生了反应:I2+2OH-=I-+IO-+H2O。
H++ClO-.在所得溶液中具有氧化性的含氯粒子有Cl2、ClO-、HClO。(4)A只有入气管,而没有出气管。错误。B.Cl2的密度比空气大,要用向上排空气法收集。错误。C.是用用向上排空气法收集,由于Cl2是大气污染物,所以在排放之前进行了尾气的吸收和处理。正确。D不能收集气体。氯气被处理吸收。错误。选项为C。(5)①Cl2有氧化性,Na2SO3有还原性,二者发生反应的化学方程式:Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。②吸收一段时间后,向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,是因为溶液中发生了反应:Cl2+2OH-=Cl-+ClO-+H2O。ClO-有强氧化性,能把I-氧化为I2。I2遇淀粉变为蓝色。随即又褪去,是因为又发生了反应:I2+2OH-=I-+IO-+H2O。
考点:考查Cl2的实验室制取原理、步骤、性质现象、化学方程式、离子方程式的书写及相应的计算的知识。


科目:高中化学 来源: 题型:计算题
接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量 千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数 。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量 千克。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高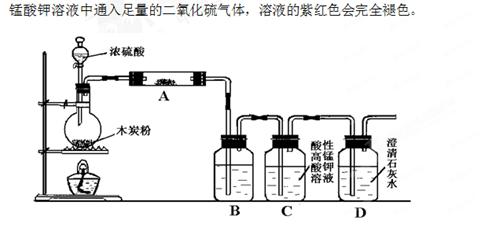
(1)组装好上述装置后,首先要进行的操作是: 。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: 。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是 、 ;B中加入的试剂和作用是 、 。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是一个制取氯气并以氯气为原料进行特定反应的装置。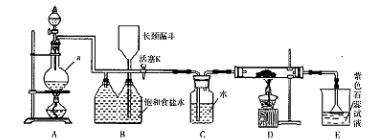
(l)A是氯气发生装置,写出其中的化学反应方程式 。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是 ;若发现装置B中该现象不明显,可能的
原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。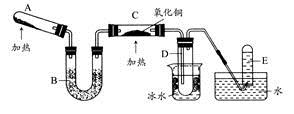
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题: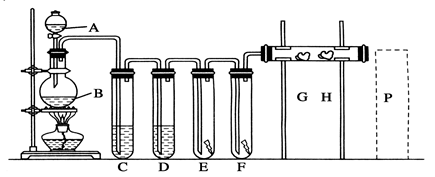
(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验。图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。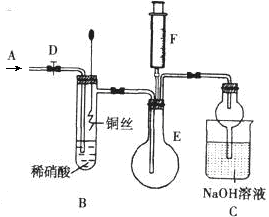
请回答有关问题:
(1)组装好装置后,关闭D,若装置的气密性良好,向外抽注射器活塞,C装置中有什么现象?
;
(2)反应开始前要向体系中通入气体A,为什么? ;A可以是 (填序号) ①N2 ②O2 ③空气 ④CO2
(3)当完成装置A的实验目的后,关闭D,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是: 。
(4)反应一段时间后,将F中空气推入E中,证明生成了NO实验现象是: 。
(5)装置C的作用是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com