
| A. | 含有0.2mol K2SO4 | |
| B. | K+的物质的量浓度为0.2mol•L-1 | |
| C. | K的物质的量为0.8mol | |
| D. | 取出1LK2SO4溶液后,剩余K2SO4溶液的浓度变为0.1mol•L-1 |
分析 A.结合n=cV计算;
B.c(K+)=2c(K2SO4);
C.结合n=cV计算;
D.溶液具有均一性.
解答 解:A.K2SO4的物质的量为2L×0.2mol/L=0.4mol,故A错误;
B.K+的物质的量浓度为0.2mol•L-1×2=0.4mol/L,故B错误;
C.K的物质的量为2L×0.2mol/L×2=0.8mol,故C正确;
D.取出1LK2SO4溶液后,剩余K2SO4溶液的浓度变为0.2mol•L-1,故D错误;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握离子浓度与溶质浓度的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:实验题
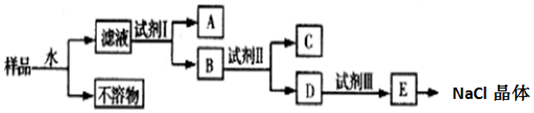
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂,氧化产物、还原产物都是N2 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系是纯净物 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 通入了1molCl2的新制氯水中,HC1O、Cl一、C1O-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 molCl2与足量Fe反应转移电子数为0.3NA | |
| B. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| C. | 常温常压下,4.2g环丙烷和聚乙烯的混合物中含有的碳原子数为0.3 NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2O的电离方程式:H2O+H2O?H3O++OH- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com