
下列根据反应原理设计的应用,不正确的是 ( )。
A.CO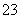 +H2OHCO
+H2OHCO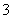 +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2OSn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
科目:高中化学 来源: 题型:
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为: .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是 .
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: .
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图1所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 .
(6)胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图2,其中配位键和氢键均采用虚线表示.
①写出基态Cu原子的核外电子排布式: 1s22s22p63s23p63d104s1或[Ar]3d104s1 ②写出胆矾晶体中水合铜离子的结构简式(用配位键表示): .
(7)决定离子空间结构的因素有 、 和离子键的纯粹程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是( )
A.钡可从氯化钾溶液中置换出钾
B.在溶液中钡离子可氧化金属锌,使之成为锌离子
C.钡可从氯化钠溶液中置换出钠
D.钡可从冷水中置换出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)原子序数比F元素大8的元素的单质与水反应的离子方程式是:
查看答案和解析>>
科目:高中化学 来源: 题型:
配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是 ( )。
A.FeSO4(Fe) B.SnCl2(HCl)
C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
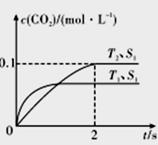
据此判断:
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积S1>S2,在答题卡相应图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
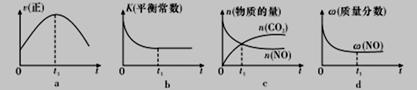
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)=N2O4(g) △H=-867kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_____________________。
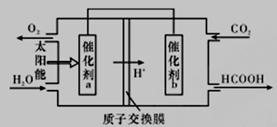
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
③常温下0. 1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka =_______________mol·L-1(填写最终计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O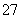 和CrO
和CrO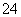 ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO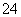
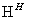 Cr2O
Cr2O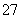
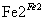 Cr3+
Cr3+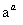 Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO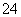 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O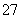 (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O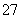 )=v(CrO
)=v(CrO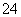 )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO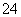 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O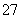 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 ( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com