
| A、Na+、Al3+、NO3-、H+ |
| B、Ba2+、Na+、Cl-、SO42- |
| C、Mg2+、H+、SO42-、OH- |
| D、H+、Na+、CO32-、Cl- |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、6.07 | B、2.62 |
| C、4.54 | D、3.43 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40mL | B、30mL |
| C、20mL | D、10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
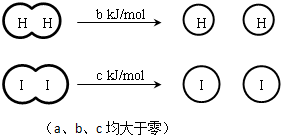
| A、H2、I2和HI分子中的化学键都是非极性共价键 |
| B、断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C、相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 |
| D、向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是某化学反应中的能量变化图.
(1)如图是某化学反应中的能量变化图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com