
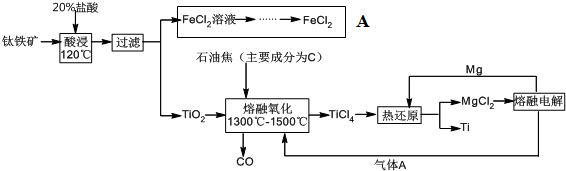
分析 (1)钛铁矿的主要成分为钛酸亚铁(FeTiO3),根据流程可知,钛酸亚铁与稀盐酸反应生成了氯化亚铁和二氧化钛;
(2)二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,据此写出反应的化学方程式;
(3)在流程图的方框内过程A是从氯化亚铁溶液中获得氯化亚铁晶体,可以用降温结晶的方法,注意要防止亚铁离子水解;
(4)根据钠与金属镁的还原性强弱进行解答;
(5)电解氯化镁生成的氯气和镁可以循环利用.
解答 解:(1)根据工艺流程可知,FeTiO3与稀盐酸反应生成了氯化亚铁和二氧化钛,反应的离子方程式为:FeTiO3+2H+$\frac{\underline{\;120℃\;}}{\;}$Fe2++TiO2+H2O,
故答案为:FeTiO3+2H+$\frac{\underline{\;120℃\;}}{\;}$Fe2++TiO2+H2O;
(2)二氧化钛的“熔融氧化”为:二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,反应的化学方程式为:TiO2+2C+2Cl2$\frac{\underline{\;1300℃-1500℃\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;1300℃-1500℃\;}}{\;}$TiCl4+2CO;
(3)在流程图的方框内过程A是从氯化亚铁溶液中获得氯化亚铁晶体,可以将溶液蒸发浓缩、冷却结晶、过滤、洗涤、在干燥的HCl气流中加热 FeCl2固体,
故答案为:蒸发浓缩、冷却结晶;
(4)由于钠的还原性强于镁,所以热还原法中可以改用钠代替镁作还原剂,
故答案为:能;
(5)电解熔融氯化镁生成金属镁和氯气,根据流程可知,金属镁和氯气都可以循环利用,
故答案为:Cl2和Mg;
点评 本题考查了物质的分离与提纯、物质制备实验方案的设计,题目难度中等,注意掌握常见物质的分离与提纯方法,明确生成流程为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
 |  |  |  |
| 防治高血压 | 防治缺铁性贫血 | 做甜味剂 | 做防腐剂 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,在恒容密闭容器中充入等体积的X、Y气体,发生反应X(g)+Y(g)?2Z(g),一段时间后达到平衡,其他条件不变,再充入0.3mol Z,平衡时Y的体积分数增大 | |
| B. | 碱性锌锰干电池工作过程中,每通过2mol电子,负极质量减轻130g | |
| C. | 通过测定CH3COONa溶液和NaHS溶液的pH,可以比较醋酸和氢硫酸酸性的强弱 | |
| D. | 将MgCl2、Mg(OH)2、MgCO3三种物质与水混合,加热、灼烧,最终的固体产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于危险化学品,其标识应为: | |
| B. | 当你走进化学实验室之前,应认真阅读实验室的安全守则 | |
| C. | 中国大陆的火警报警电话为“119”,香港、澳门为“999” | |
| D. | 一般情况下,金属类物质着火时不宜使用二氧化碳类灭火器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的密度小于K的密度,故K与水反应,K不会浮在水面上 | |
| B. | Na2O2具有强氧化性,用途上可用做漂白剂 | |
| C. | Na2CO3俗称“小苏打”,可用于治疗胃酸过多 | |
| D. | K-Na合金因为具有很强的还原性,故可用作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体中每个Xn+周围有2个等距离且最近的N3- | |
| B. | Xn+中n=l | |
| C. | 该晶体中阳离子与阴离子个数比为3:1 | |
| D. | X元素的原子序数是19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1mol/L的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
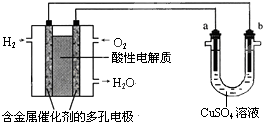
| A. | 燃料电池工作时,正极反应为:O2+4H+-4e-═2H2O | |
| B. | a极是粗铜,b极是纯铜,CuSO4溶液作电解质溶液时,CuSO4溶液浓度保持不变 | |
| C. | a、b两极均是石墨,CuSO4溶液作电解质溶液时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是铜,b极是铁,NaCl溶液作电解质溶液时铁受到保护,腐蚀速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com