
分析 (1)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应;
(2)NH3•H2O为弱电解质,部分电离;
(3)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳;Al(OH)3与盐酸反应生成氯化铝和水;
(4)Ba(OH)2溶液中逐滴加入稀硫酸,反应生成硫酸钡和水;向Ba(OH)2溶液中通入过量的CO2反应生成碳酸氢钡.
解答 解:(1)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应,如Ba(OH)2+2HCl=BaCl2+2H2O,
故答案为:Ba(OH)2+2HCl=BaCl2+2H2O;
(2)NH3•H2O为弱电解质,部分电离,电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(3)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+═H2O+CO2↑;Al(OH)3与盐酸反应生成氯化铝和水,离子反应为Al(OH)3+3H+═3H2O+Al3+,故答案为:HCO3-+H+═H2O+CO2↑;Al(OH)3+3H+═3H2O+Al3+;
(4)Ba(OH)2溶液中逐滴加入稀硫酸,反应生成硫酸钡和水,离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,
向Ba(OH)2溶液中通入过量的CO2反应生成碳酸氢钡,离子反应为CO2+OH-=HCO3-,
故答案为:Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓;CO2+OH-=HCO3-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及与量有关的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 聚合物(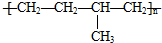 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
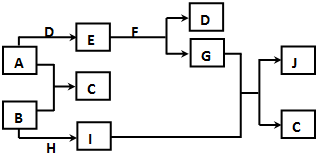 现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
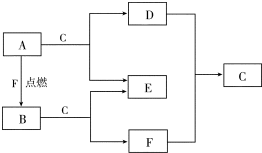 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
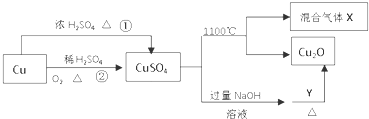
| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖 | |
| C. | CuSO4在1100℃分解所得混合气体X可能是SO2和SO3 | |
| D. | CuSO4可用于配制农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)△H<0 | B. | 2FeCl3(aq)+Fe(s)═3FeCl2(aq)△H<0 | ||
| C. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l)△H<0 | D. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl NaClO HCl | B. | KCl KClO HClO | ||
| C. | Na2S Na2SO3 H2SO3 | D. | K2S K2SO3 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com