

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
分析 (1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒书写化学方程式;根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;根据冷却塔1、2的温度与白磷的熔点比较分析白磷的状态;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;
(5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大.
解答 解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%,
故答案为:69;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒定律可得反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
根据P元素守恒可得关系式P2O5~2H3PO4,142份P2O5可制取196份磷酸,1t折合含有P2O5约30%的磷灰石,含有P2O5的质量为0.3t,所以可制得到85%的商品磷酸的质量为$\frac{196×0.3t}{142×85%}$=0.49t,
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;冷却塔1的温度是70℃,280.5℃>t>44℃,所以此时主要的沉积物是液态白磷;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷,
故答案为:CaSiO3;液态白磷;固态白磷;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3,
故答案为:SiF4、CO;SiF4、H2S、HF;PH3;
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂质少,因此逐渐被采用,
故答案为:产品纯度高.
点评 本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关计算,该题是高考中的常见题型,题目难度中等,侧重对学生分析问题、解答问题能力的培养.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
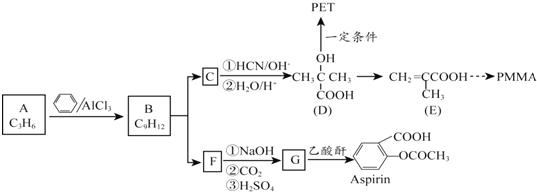
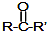 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$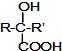
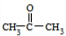 .
.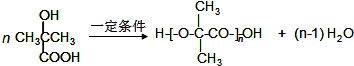 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com