

| A、电流从锌电极经金属导线流向铜电极 |
| B、锌为阴极,铜为阳极 |
| C、负极的电极反应式为:Zn-2e→Zn2+ |
| D、一段时间后,溶液中阳离子总浓度增大、阴离子浓度不变 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
| A、纯碱厂用侯氏制碱法制纯碱 |
| B、硝酸厂用氨氧化法制硝酸 |
| C、硫酸厂用接触法生产硫酸 |
| D、氮肥厂用氮气和氢气合成氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、在1L 0.2mol?L-1的硫酸铁溶液中含有的铁离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④全正确 |
| B、只有①②③正确 |
| C、只有①③正确 |
| D、只有①③④正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、金属的晶胞如图所示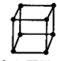 ,其配位数为8 ,其配位数为8 | ||||||||
| B、SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为sp3杂化,是直线型分子 | ||||||||
| C、醋酸钠溶液中离子浓度的关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||||||||
D、已知反应2CH3OH(g)?CH3OCH3+H2O(g),某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量CH3OH,某时刻测得各组分浓度如下表,则此时正、逆反应速率的大小关系为:v正>v逆
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH小于7 |
| B、存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、25℃时,由水电离产生的c(H+)>1×10-7mol?L-1 |
| D、向溶液中加入少量NaOH固体,c(S2-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com