
��֪����ʱ��Mg(OH)2���ܶȻ�����Ksp��5.6��10-12��ȡ������MgCl2��Һ������һ�������ռ���Һ�ﵽ�����ܽ�ƽ�⣬���pH��12.0��������˵������ȷ���� ( )
A��������Һ�е�c(H+)��1.0��10��12 mol��L-1
B�����ӵ��ռ���ҺpH��12.0
C��������Һ����ˮ���������c(OH��)��1.0��10��12 mol��L��1
D��������Һ�е�c(Mg2+)��5.6��10��8 mol��L-1
 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
������þ(MgO2)������ϡ�ᣬ�����������������⣬��ҽѧ�Ͽ���Ϊ������ȡ�������þ��Ʒ�г����������MgO��ʵ���ҿ�ͨ�����ַ����ⶨ��Ʒ�й�����þ�ĺ�����
(1)ij�о�С��������ͼװ�òⶨһ����������Ʒ�й�����þ�ĺ�����
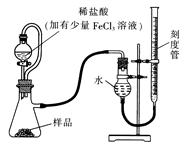
��ʵ��ǰ����еIJ����� ���� ��ϡ�����м�������FeCl3��Һ�������� �������� ��
���ú�ѹ��Һ©�����ŵ��У�ʹ��Һ©���е���Һ˳�����£� ��
��ʵ������ʱ�����ָ������£��� ���������� ����ƽ�ӿ̶��߶�����
(2)ʵ���һ���ͨ���������ַ����ⶨ��Ʒ�й�����þ�ĺ�����
����I��ȡa g��Ʒ����������ϡ���ᣬ��ַ�Ӧ���ټ��� NaOH��Һ��Mg2��������ȫ�����ˡ�ϴ�Ӻ�����������գ����յõ�b g���塣
��֪������Ksp[Mg(OH)2]=l��10��11��Ϊʹ����I��Mg2+��ȫ����[����Һ��c(Mg2+)��l ��10��5mol/L]����Һ��pH����Ӧ���� ��
�������õ�����ƽ��ȡ0.1000g��Ʒ������ƿ�У�����15 mL0.6 mol/LKI��Һ���������ᣬҡ�Ⱥ��ڰ�������5 min���������� ��ָʾ����Ȼ���� ��ʽ�ζ���ʢװ0. 1000 mol/L Na2S2O3��Һ���еζ�. (��֪��I2+2Na2S2O3= Na2S4O6+2NaI)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������人�����ص�ѧУ�߶���ѧ����ĩͳ����ѧ���������棩 ���ͣ������
��12�֣���Ҫ��ش���������
��1���ñ�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ�÷�̪��ָʾ�������в����лᵼ��ʵ����ƫ�͵��� (����� )
�ټ�ʽ�ζ���������ˮϴ����û���ñ�Һ��ϴ
����ƿ������ˮϴ����û���ô���Һ��ϴ
������ʽ�ζ��ܼӴ���Һʱ����������ˮϴ����ĵζ���δ�ô���Һ��ϴ
�ܵζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ
���յ����ʱ���ӣ���������������ȷ
��2��ij����С��ͬѧ����ͼ��װ�ý���ʵ�飬�Դ��������⣺

 ������ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е�
��ʴ��
������ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е�
��ʴ��
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ��
��3��������,���ȡ0.1mol/L HA��Һ��0.1mol/L NaOH��Һ��������(���Ի�Ϻ���Һ����ı仯),��û����Һ��pH=8��������Һ��������ʽ�ľ�ȷ����������������֣���c(OH��)��c(HA)�� ___________ mol/L��
��4����Cl����Al3����HSO4����K����HS�����������У�ֻ��ˮ�ⲻ�ܵ���������� ��ֻ�ܵ��벻��ˮ��������� �����ܵ�������ˮ��������� ��д����ˮ�����ӵ�ˮ�����ӷ���ʽ �� ��
��5����֪25��ʱ��Mg(OH)2���ܶȻ�����Ksp = 5.6��10��12�����ij��Һ��pH = 13������¶�����Һ�е�c(Mg2+) = ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com