
����Ŀ������ij��Ѫ����Ҫ�ɷ��������������壨FeSO47H2O����Ϊ�ⶨ�ò�Ѫ������Ԫ�صĺ�����ij��ѧ��ȤС�����������ʵ�鷽��������һ���ζ�����������KMnO4��Һ�ζ�������Ҫ�������£�
��ȡһ������Ѫ����Ʒ���ܽ��ȥ������������Ԫ�أ��������Ƴ�250mL������Һ��
����ȡ25.00mL������Һ����ƿ�У�
�����ữ��0.0100mol/LKMnO4��Һ�ζ����յ㣬��¼����KMnO4��Һ������ظ�һ������ʵ�飮
����֪��5Fe 2++MnO4��+8H+��5Fe 3++Mn2++4H2O����
��1��250mL������Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬���������������ƣ����ζ�ʱ�����ֿ��Ƶζ��ܵĻ���������ҡ����ƿ���۾�ע����ʱ����ζ��յ㣮
��2������ʵ���е�KMnO4��Һ��Ҫ�ữ�����ֱ�������������ữ���Բⶨ�����Ӱ���ǣ����� �� ���� �� ���� �� ���ƫ����ƫС������Ӱ�족��
��3��������������������FeSO4ת��ΪFe2O3 �� �ⶨ�������������������£�
����ټ���1mlϡ�����Ŀ���� ��
��4��������Ƿ����ʡ�� �� ������ ��
��5����������ظ��������ȡ���ȴ��������ֱ��Ϊֹ��
��6������ʵ������Ԫ������ģ���ÿƬ��Ѫ������Ԫ�ص�����g���ú�a�Ĵ���ʽ��ʾ����
���𰸡�
��1��������250mL����ƿ����ƿ����Һ����ɫ�仯����Һ����dz�Ϻ�ɫ�ұ���30s����
��2��ƫС����Ӱ�죻ƫ��
��3����ֹ��������ˮ��
��4�����ܣ�Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ���
��5�����γ�����������С��0.1g
��6��0.07a
���������⣺��1����ȷ����250mL������Һ������ʱ��Ҫ�IJ��������в������ձ�����ͷ�ιܡ�250mL����ƿ���ݴ˵ζ��IJ���Ҫ���֪���ζ�ʱ�����ֿ��Ƶζ��ܵĻ���������ҡ����ƿ���۾�ע����ƿ����Һ����ɫ�仯����������Һ����dz�Ϻ�ɫ�ұ���30s����ʱ����ζ��յ㣻���Դ��ǣ�������250mL����ƿ����ƿ����Һ����ɫ�仯����Һ����dz�Ϻ�ɫ�ұ���30s���䣻��2��������ǿ�����ԣ����Լ�С������ص�������������л�ԭ�ԣ������˸�����ص������������ʵ��û��Ӱ�죬�����������ữ��ʹ�ⶨ���ƫС���������ữ��ʹ�ⶨ���ƫ���������ữ�Բⶨ�����Ӱ�죬���Դ��ǣ�ƫС����Ӱ�졢ƫ��3������������ˮ�⣬�ܽ�ʱҪ������ˮ�⣬���Լ���1mlϡ�����Ŀ���Ƿ�ֹ��������ˮ�⣬���Դ��ǣ���ֹ��������ˮ�⣻��4��Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ������ʲ���ڲ���ʡ�ԣ����Դ��ǣ����ܣ�Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ�������5���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ�����������������Ϊ�˱�֤���ճ�֣�Ҫʹ���õ��Ĺ������Ϊֹ�������ظ��������ȡ���ȴ��������ֱ�����γ�����������С��0.1gΪֹ�����Դ��ǣ����γ�����������С��0.1g����6��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص����� ![]() =0.07ag�����Դ��ǣ�0.07a��
=0.07ag�����Դ��ǣ�0.07a��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�SiCl4��g��+2H2��g��Si��s��+4HCl��g������H=+Q kJmol��1��Q��0����ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���ǣ� ��
A.��Ӧ�����У�������ѹǿ�����SiCl4��ת����
B.����Ӧ��ʼʱSiCl4Ϊ1 mol�����ƽ��ʱ����������ΪQ kJ
C.��Ӧ4 minʱ����HClŨ��Ϊ0.12 molL��1 �� ��H2��Ӧ����Ϊ0.03 molL��1min��1
D.����Ӧ��������Ϊ0.025Q kJʱ�����ɵ�HClͨ��100 mL 1 molL��1��NaOH��Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ����ȷ����
A. 1 mol H2 B. 1 mol ���� C. 1 mol NH4+ D. 1 mol ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��Ա��еĢ١����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��գ�
��1������ЩԪ���У�����ʧ���ӵ�Ԫ����____���ǽ�������ǿ��Ԫ����____��
��2����ѧ��������õ�Ԫ����____����ԭ�ӽṹʾ��ͼΪ__________��
��3��Ԫ�ص�����������Ӧ��ˮ�����г����Ե���������������������Һ��Ӧ�����ӷ���ʽ��______________________________��
��4���ڢڢݢߢ�����Ԫ���У�ԭ�Ӱ뾶�ɴ�С��˳����___________________
��5���ڢۢܢ�����Ԫ���У����Ӱ뾶�ɴ�С��˳����___________________��
��6��Ԫ�آޡ��������������Ӧ��ˮ�����У����Խ�ǿ����___________________��
��7�������ʵ��֤����ԭ�ӵõ��������Ȣ�ԭ��ǿ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ��ʳ�����ϣ���Ҫ�������͡����̵ļӹ�����Ҳ�������л��ϳɣ���AΪԭ���Ʊ���������֬M�����߷��Ӳ���N�ĺϳ�·�����£�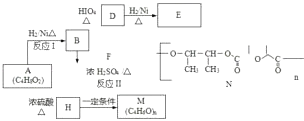
��֪�� ![]()
��1��д����Ӧ���ͣ���ӦI����ӦII ��
��2��A�й����ŵ���������A���������ͬ���칹�����֣�����ֻ��һ������ͬ���칹�Ľṹ��ʽ�ǣ� ��
��3��D������Cu��OH��2��Ӧ�Ļ�ѧ����ʽ�� ��
��4��M�Ľṹ��ʽΪ ��
��5��ij�л���CxHyOz��0��z��5����A������Ȼ�Ϻ�ȼ�գ�ÿĦ�����������5Ħ����������д�����л�����ܵķ���ʽ �� ��д���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽����������(����)
A.����ˮ�����顢���Ȼ�̼���Ҵ�������ɫҺ��
B.��֬��������������ķ���ʹ��֬�����ƺ��ͳ�ַ���
C.���ó���ʯ��ˮ����Na2CO3��Һ��NaHCO3��Һ
D.Ϊȷ�ⶨ������NaOH��Һ��Ӧ���к��ȣ�������ͼ�����ʵ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ�����������壬BΪ����ɫ�����CΪ����Һ�壬DΪ����ɫ���嵥�ʣ����Ӧ�Ĺ�ϵ����ͼ��ʾ��M��ˮ��Һ��ɱ�������������й�������ȷ����
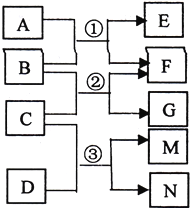
A. 4.4gA����4.4NA������
B. 7.8gB������A������Ӧ�٣���ת��0.2NA����
C. ��Ӧ�۵����ӷ���ʽΪ��Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M�ĵ���ʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ŷŵĹ�ҵ��ˮ�п��ܺ���K+��H+��Mg2+��SO42����Cl����NO3�� ���ӡ�������ˮ�����Եļ��������ȷ���ó���ˮ�п϶������е����������(�� �� )
A. H+��K+��NO3�� B. K+��NO3����SO42��
C. H+��Mg2+ D. K+��Mg2+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2 mol O2 ����˵������ȷ����(�� ��)
A. ����2NA�������� B. ����2mol��ԭ��
C. ����Ϊ64g D. ��������Ϊ44.8L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com