
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
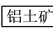

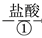

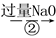
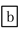

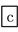
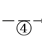
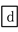

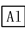
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:2017届河北省石家庄市高三上第一次阶段考试化学卷(解析版) 题型:选择题
下列说法不正确的是
A.Si与SiO2在常温下都可与NaOH溶液反应
B.C与SiO2之间可以反应制备Si,同时得到CO
C.Si与SiO2都可以与氢氟酸反应
D.Si→SiO2→H2SiO3可以通过一步反应实现
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
下列说法中正确的是( )
①钠在空气中燃烧生成淡黄色的Na2O2
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A.②③ B.①②③ C.①②③④ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:实验题
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2•6H2O)的过程为:

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。能否用新制氯水代替双氧水________(填“能”或“否”)。
(3)在步骤②~ ③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为_______。
③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为_______。
A.1.5 B.4 C.9.7 D.氧化钠
E氢氧化锶粉末 F碳酸钠晶体 G氧化锶粉末
(4)操作③中所得滤渣的主要成分是__________(填化学 式)。
式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是__________。
(6)步骤⑥中,洗涤氯化锶晶体最好选用___________。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:选择题
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合右图。则甲和X不可能是 ( )
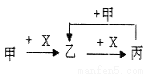
A.甲:Na、X:O2 B.甲:NaOH溶液、X:CO2溶液
C.甲:C、X:O2  D.甲:AlCl3溶液、X
D.甲:AlCl3溶液、X :NaOH溶液
:NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.标 准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
B.1molC8H18分子中含有的共用电子对数为26NA
C.足量的Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA
D.常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:实验题
实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。

(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
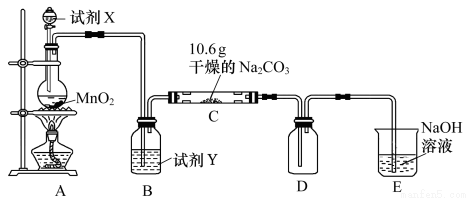
⑴写出装置A中发生反应的化学方程式: 。
⑵写出试剂Y的名称:__________________。
⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和_____________;
假设2:存在三种成分:NaHCO3、_____________和_____________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中 | — |
步骤2: | |
步骤3: |
⑷已知C中有0.1 mol Cl2参加反应。若假设1成立,可推知C中反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:填空题
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0kJ·mol-1和726.5 kJ·mol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________,石墨电极的质量是否发生变化 ___________ (填“是”或“否”)。

(3)常温下甲酸K=1×10-4。20.00mL0.1000mol·L-1NaOH溶液与一定量等物质的量浓度甲酸溶液混合后所得溶液中c(HCOOH)=c(HCOO-),该溶液c(H+)=________mol·L-1,所用甲酸的体积 ____40.00mL(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为________________。
(4)已知Ksp(BaSO4)=1.1×10-10,若向50.00 mL0.009 mol·L-1 Ba(NO3)2溶液中加入50.00 mL 0.010mol·L-1稀硫酸,混合后溶液中c(Ba2+)=_________ mol·L-1,pH=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com