
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2)Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为_________、______________、_____________ (各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
【答案】第二周期IVA族 S2- N≡N 0.045mol/L(或1/22.4mol/L) HNO3(或HNO2) NH3·H2O NH4NO3(或NH4NO2) C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
试题X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,则X是H元素;Y原子的最外层电子数是其电子层数的2倍,则Y是C元素;Z、M左右相邻,M、W位于同主族,则Z、M、W分别为N、O、S元素。
(1)Y在周期表中的位置是第二周期IVA族, W的阴离子符号是S2-。
(2)Z的单质是氮气,其结构式为N≡N。标准状况下,试管中收集满Z的简单氢化物(即氨气),后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内充满溶液。假设试管的容积为22.4L,则氨气的物质的量为1mol,溶解后得到氨水的体积也是22.4L,所以溶液中溶质的物质的量浓度为0.045mol/L(或1/22.4mol/L)。
(3)由H、N、O三种元素组成的化合物是酸、碱、盐的化学式分别为HNO3(或HNO2)、NH3·H2O、NH4NO3(或NH4NO2)。
(4)碳与浓硝酸在加热时发生反应的化学方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
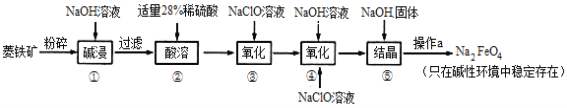
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确的是
A. 32.5 g Zn与一定量浓硫酸完全反应,生成的气体分子数目小于0.5NA
B. 2H2S+SO2 = 3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1 : 2
C. 将NO2和O2等体积混合充满试管,倒置于水槽中充分反应,试管中剩余气体占试管容积的1/8
D. 常温常压下(Vm=24.5L/mol),用排空气法收集HCl气体于干燥烧瓶做喷泉实验,假设烧瓶内溶液不外溢,所得盐酸的物质的量浓度为1/24.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是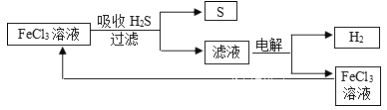
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
(查阅资料)碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
(碘的制取)以海带为原料,按照以下步骤进行实验。

(1)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为________。
(2)步骤C中使用的起到分离作用的仪器是_______,使用该仪器时,第一步操作是_______________。
(3)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
(4)(碘的分离)得到含I2的CCl4溶液后,利用下图装置进行碘的提取并回收溶剂。

图中有两处明显错误,分别是①_________;②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列污水处理的方法中,表示其原理的离子方程式不正确的是
A.混凝法,用明矾做混凝剂:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用过量CO2中和碱性废水:CO2+2OH—=CO32—
C.沉淀法,用Na2S处理含Hg2+废水:Hg2++S2—=HgS↓
D.氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
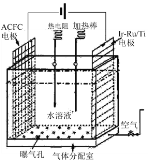
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
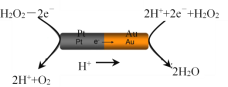
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
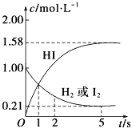
请回答下列问题:
(1)V=______。
(2)该反应达到最大限度的时间是_______,该时间内平均反应速率v(HI)=________。
(3)下列说法中可以说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是_____。
H2(g)+I2(g)已达到平衡状态的是_____。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com