
| A、常温下,反应4Na(s)+O2(g)═2Na2O(s)的△H<0,△S>0 | |||
| B、反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 | |||
| C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |||
D、反应2SO2+O2
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
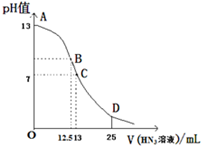 纯叠氮酸(HN3)是无色液体,对热十分稳定,但受撞击就爆炸,常用作引爆剂,如图为常温下向25ml0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1的HN3溶液过程中溶液的pH的变化曲线(溶液混合时体积变化忽略不计).
纯叠氮酸(HN3)是无色液体,对热十分稳定,但受撞击就爆炸,常用作引爆剂,如图为常温下向25ml0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1的HN3溶液过程中溶液的pH的变化曲线(溶液混合时体积变化忽略不计).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 H++2e-═H2↑ |
| B、O2+2H2O+4e-═4OH- |
| C、Fe-2e-═Fe2+ |
| D、4 OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀硫酸反应 |
| B、Ba(OH)2?8H2O晶体与氯化铵晶体反应 |
| C、盐酸与氢氧化钠溶液反应 |
| D、乙醇在空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com