
| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液 | B. | HI溶液 | C. | NaOH溶液 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
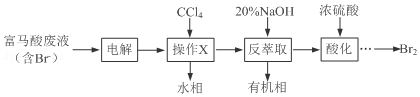
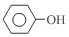 +3Br2→
+3Br2→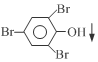 +3HBr
+3HBr查看答案和解析>>
科目:高中化学 来源: 题型:推断题
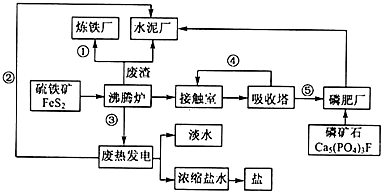 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com