
某合金与铁的物理性质的比较如表所示:
| 熔点/℃ | 密度/g·cm-3 | 硬度(金刚 石为10) | 导电性(银 为100) | |
| 某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1 535 | 7.86 | 4.5 | 17 |
还知该合金耐腐蚀,强度大,从以上性能看,该合金不适合作( )
A.导线 B.门窗框
C.炉具 D.飞机外壳
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
环氧乙烷的化学式为C2H4O,关于环氧乙烷的下列说法正确的是
A、它是氧化物 B、它是含有3种元素的混合物
C、它的摩尔质量是44g D常温下,1 mol环氧乙烷含有2NA个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生
B.反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH>0
C.由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3 沉淀
D.25℃时,0.1 mol·L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液的说法正确的是( )
A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质
B.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解
C.室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32—、SO32—、SO42—、C1—中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
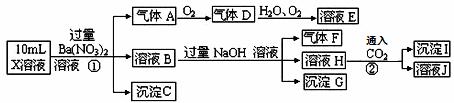
下列说法正确的是( )
A.X中肯定存在Fe2+、NH4+、SO42— B.溶液E和气体F不能发生化学反应
C.X中肯定不存在CO32—、SO32—、C1— D.沉淀I是A1(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量可能为( )
A.3.2 g B.4.0 g C.4.2 g D.4.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. NaHCO3溶液和NaAlO2溶液混合会放出CO2
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
D.AlCl3溶液和NaAlO2溶液加热蒸干、灼烧都得到Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
A.10min后,升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1•min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
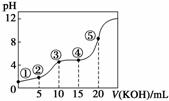 (1)点①所示溶液中,Kw=__________。
(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为_________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=
________________________________________________________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为____________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是______,最小的是________(用序号回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com