
| A、将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1:20 |
| B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2 c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等 |


科目:高中化学 来源: 题型:
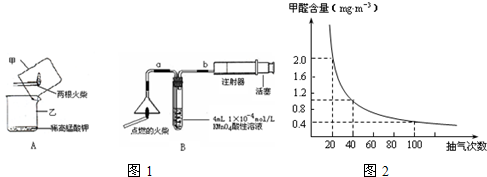
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、量筒 | B、容量瓶 |
| C、滴定管 | D、以上均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
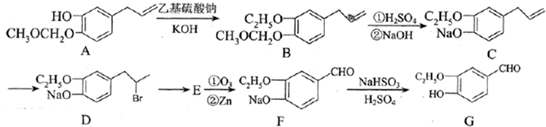
| ①O3 |
| ②Zn |
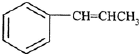 为原料制备
为原料制备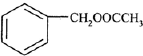 的合成路线流程图(无机试剂
的合成路线流程图(无机试剂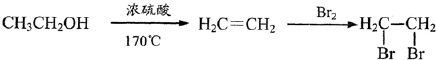
查看答案和解析>>
科目:高中化学 来源: 题型:
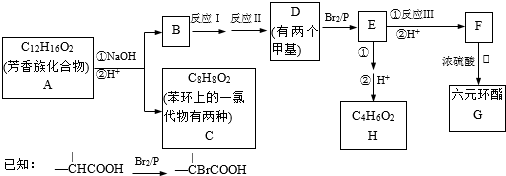
查看答案和解析>>
科目:高中化学 来源: 题型:
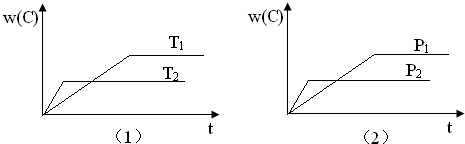
| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com