
分析 根据燃烧法:碳元素对应的燃烧产物是二氧化碳,氢元素对应燃烧产物是水,根据元素守恒来确定有机物的化学式,根据同分异构现象来确定有机物的结构简式,结合烃的性质分析.
解答 解:(1)0.1mol某气态链烃,生成水的物质的物质的量n=$\frac{m}{M}$=$\frac{7.2g}{18g/mol}$=0.4mol,
即含H物质的量=2×0.4mol=0.8mol,因为是气态烃,所以该烃可写成:CxH8,x=3或4,则可能是C3H8和C4H8,不存在同分异构现象,C4H8有CH2=C(CH3)2、CH2=CHCH2CH3、CH3CH=CHCH3三种同分异构体,所以可能的结构简式:CH3CH2CH3、CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2.
答:分子式为C3H8或C4H8;结构简式分别为:CH3CH2CH3、CH2=C(CH3)2、CH2=CHCH2CH3、CH3CH=CHCH3;
(2)CH3CH2CH3的名称为丙烷;CH2=C(CH3)2的名称为2-甲基-1-丙烯,CH2=CHCH2CH3的名称为1-丁烯,CH3CH=CHCH3的名称为2-丁烯;
答:CH3CH2CH3:丙烷;CH2=C(CH3)2:2-甲基-1-丙烯,CH2=CHCH2CH3:1-丁烯,CH3CH=CHCH3:2-丁烯;
(3)经测定该烃存在支链,则为CH2=C(CH3)2,属于烯烃,能被高锰酸钾氧化,能与溴水发生加成反应使溴水褪色,CH2=C(CH3)2完全燃烧生成二氧化碳和水,反应的化学方程式为:C4H8+6O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+4H2O;
答:能被酸性KMnO4溶液氧化、能与溴水发生反应使溴水褪色;C4H8+6O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+4H2O.
点评 本题考查学生燃烧法确定有机物分子式的方法、同分异构体、烃的性质等,属于基本知识的考查,注意把握同分异构体的书写方法和烯烃的性质,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 | |
| D. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
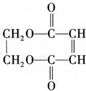 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图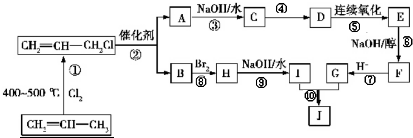
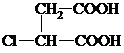 +3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;
+3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;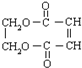 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
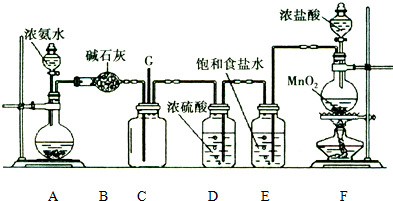
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
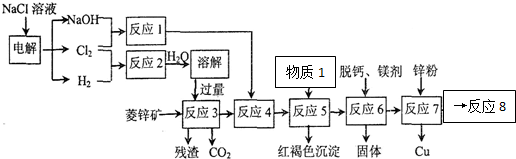
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
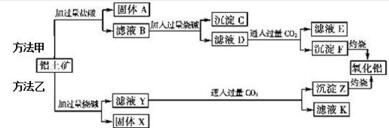
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生丁达尔现象 | |
| B. | 胶体粒子能通过滤纸空隙 | |
| C. | 胶体在一定条件下能稳定存在 | |
| D. | 胶体分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com