
【题目】溴酸镉[Cd(BrO3)2]常用做分析试剂、生产荧光粉等。以镉铁矿(成分为 CdO2、Fe2O3、FeO 及少量的Al2O3 和SiO2)为原料制备[Cd(BrO3)2]的工艺流程如下:

已知 Cd(SO4)2 溶于水,回答下列问题:
(1)为提高镉的浸取率,酸浸时可采取的措施有 ____________(任写两种即可)。
(2)还原镉时,产生能使澄清石灰水变浑浊的气体,发生的离子反应方程式为 ________。
(3)加入H2O2 溶液的目的是_________。
(4)滤渣2 的主要成分为_______________ (填化学式);为检验滤液中是否含有 Fe3+离子,可选用的化学试剂是__________________ 。
(5)实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中 Cd2+的含量, 其原理是:Cd2++ 2NaR=2Na++ CdR2 ,其中 NaR 为阳离子交换树脂。常温下,将沉镉后的溶液(此时溶液 pH=6)经过阳离子交换树脂后,测得溶液中的 Na+比交换前增加了 0.0552 g/L,则该条件下Cd(OH)2 的 Ksp 值 为___________。
(6)已知镉铁矿中 CdO2 的含量为 72 %,整个流程中镉元素的损耗率为 10 %,则 2t 该镉铁矿可制得 Cd(BrO3)2(摩尔质量为 368 g/mol)质量为 ________kg。
【答案】增大稀硫酸浓度、将固体粉碎、用玻璃棒搅拌或适当加热等措施(写出两种即可) 3Cd4++CH3OH+H2O=3Cd2++CO2↑+6H+ 将溶液中的Fe2+氧化为Fe3+ Al(OH)3、Fe(OH)3 KSCN 1.2![]() 10-19 3312
10-19 3312
【解析】
用稀硫酸溶解镉铁矿,其中SiO2不溶于水和酸,通过过滤出去,即滤渣1为SiO2;滤液中主要含有Fe2+、Fe3+、Al3+和Cd4+,加入CH3OH将Cd4+还原为Cd2+,然后加入H2O2溶液,将溶液中的Fe2+氧化为Fe3+,再调节溶液pH使溶液中的Al3+和Fe3+完全转化为Al(OH)3、Fe(OH)3沉淀,过滤除去不溶物(滤渣2),向含有CdSO4的滤液中加入K2CO3生成CdCO3沉淀,再过滤将沉淀溶于HBrO3,最后将溶液蒸发结晶即可得到溴酸镉,据此分析。
(1)固体溶解于稀硫酸时,采取增大稀硫酸浓度、将固体粉碎、用玻璃棒搅拌或适当加热等措施,可提高镉的浸出率;
(2)CH3OH将Cd4+还原为Cd2+时,产生是澄清石灰水变浑浊的气体,此气体为CO2,结合守恒法,可知反应的离子方程式为3Cd4++CH3OH+H2O=3Cd2++CO2↑+6H+;
(3)加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+;
(4)滤渣2的主要成分为Al(OH)3、Fe(OH)3;为检验滤液中是否含有 Fe3+离子,可选用的化学试剂是KSCN;
(5)沉淀后的溶液pH=6,则c(OH-)=10-8mol/L,经阳离子交换树脂后,测得溶液中Na+比交换前增加了0.0552g/L,即Na+浓度增加了 =0.0024mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.0012mol/L,则Cd(OH)2的Ksp=c(Cd2+)
=0.0024mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.0012mol/L,则Cd(OH)2的Ksp=c(Cd2+)![]() c2(OH-)=1.2
c2(OH-)=1.2![]() 10-19;
10-19;
(6)2t该矿石中CdO2的质量为2![]() 106g
106g![]() 72%=1.44
72%=1.44![]() 106g,其物质的量为
106g,其物质的量为![]() =1
=1![]() 104mol,整个流程中镉元素的损耗率为10%,根据原子守恒可知Cd(BrO3)2的物质的量为104mol
104mol,整个流程中镉元素的损耗率为10%,根据原子守恒可知Cd(BrO3)2的物质的量为104mol![]() (1-10%)=9
(1-10%)=9![]() 103mol,其质量为9
103mol,其质量为9![]() 103mol
103mol![]() 368g/mol=3312000g=3312kg。
368g/mol=3312000g=3312kg。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日某著名白酒生产企业又陷入“塑化剂”事件。据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌。常见的塑化剂DEHP分子结构如下:关于该塑化剂的说法错误的是 ( )

A. 塑化剂DEHP分子中含有碳、氢和氧三种元素
B. 塑化剂DEHP分子中至少含有两种官能团
C. 塑化剂DEHP分子易溶于酒精
D. 塑化剂DEHP分子可发生取代反应 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)![]() 的系统命名____。
的系统命名____。
(2)2,5-二甲基-2,4-己二烯的结构简式:___。
(3)![]() 的键线式:____。
的键线式:____。
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为____。
(5)有机物二苯甲烷![]() 中,该分子中有__种不同化学环境的H原子。
中,该分子中有__种不同化学环境的H原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应![]() ,回答下列问题:
,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:______。
②该反应中______元素被还原,______元素被氧化。
③在该反应中,若有![]() 电子发生转移,在标准状况下,可生成
电子发生转移,在标准状况下,可生成![]() 的体积为_____L。
的体积为_____L。
(2)配平化学方程式且回答下列问题:
①______ ![]() ______
______![]() ___
___![]() _____
_____![]() ___ Cl2 ___H2O
___ Cl2 ___H2O
②若生成![]() ,则被氧化的HCl是_________mol,
,则被氧化的HCl是_________mol,
(3)已知反应:2H2S+H2SO3=2H2O +3S,若氧化产物比还原产物多![]() ,则同时会生成水的质量为 ______ g。
,则同时会生成水的质量为 ______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
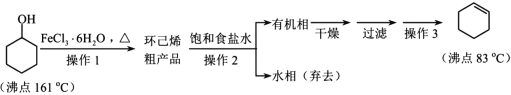
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
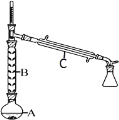
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是
A.N2+O2 ![]() 2NOB.2NO+O2 → 2NO2
2NOB.2NO+O2 → 2NO2
C.4NH3+5O2![]() 4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com