
 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.分析 (1)依据溶液中存在的阴阳离子结合电荷守恒分析判断可能的溶质微粒;
(2)A、分析离子浓度关系可知溶液呈碱性判断溶液中的溶质;
B、溶液呈酸性的溶质可以是NH4Cl,NH4Cl和HCl;
C、结合溶液中电荷守恒分析判断;
D、结合溶液中电荷守恒分析判断;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl;
(4)NH3•H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用,由此分析解答;
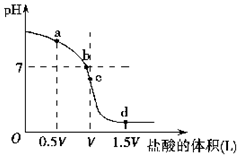
(5)用一定浓度的HCl滴定V L同浓度NH3•H2O,a是氨水和氯化铵的混合物,c是氯化铵溶液;
解答 解:(1)某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知该溶液中含有一种或两种溶质,查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,依据溶液中存在的阴阳离子结合电荷守恒分析判断可能的溶质微粒为,NH4Cl、NH3•H2O和NH4Cl、NH4Cl和HCl,组成这种溶液的可能的溶质组合有3种,
故答案为:3;
(2)A.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3•H2O,故A正确;
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质可以是NH4Cl或NH4Cl和HCl混合溶液,故B错误;
C.若溶液中c(NH4+)=c(Cl-),溶液中电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(OH-)=c(H+),则该溶液一定显中性,故C正确;
D.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中c(NH3•H2O)>c(Cl-),则溶液中溶质为NH3•H2O和NH4Cl,一定显碱性,故D正确;
故答案为:B.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl,混合前c(HCl)<c(NH3•H2O),pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)<c(NH3•H2O),
故答案为:<;pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)<c(NH3•H2O)
(4)NH3•H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用,所以两者恰好完全反应生成氯化铵,对水电离促进程度最大,即为c,
故答案为:c;分析题图可知,c点时盐酸和氨水正好完全反应,生成氯化铵溶液,这时水的电离程度最大;
(5)a点是等浓度的氨水和氯化铵的混合物,一水合氨电离大于铵根离子电离溶液显碱性,溶液中离子浓度:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c点是恰好完全反应生成的氯化铵溶液,铵根离子水解溶液显酸性,离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c(Cl-)>c(NH4+)>c(H+)>c(OH-);
点评 本题考查了弱电解质的电离、盐类水解等知识点,根据弱电解质电离、盐类水解特点来分析解答即可,结合物料守恒和电荷守恒解答,根据离子的水解确定阳离子浓度相对大小,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.1mol | ||
| C. | 小于0.1mol | D. | 大于0.1mol,小于0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/pm | 160 | 143 | 102 | 56 | 117 |
| 主要化合价 | +2 | +3 | +6,+4,-2 | -1 | +6,+4,-2 |
| A. | 元素A和B的最高价氧化物均可用作耐火材料 | |
| B. | 由元素B,C组成的化合物可以通过单质与单质化合制得,也可以在溶液中通过复分解反应制得 | |
| C. | 气态氢化物的还原性:C>E | |
| D. | D元素的非金属性最强,其最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| B. | 用BaCl2溶液鉴别Na2CO3溶液与Na2SO4溶液 | |
| C. | 用加热、称重的方法鉴别NaCl固体和Ca(HCO3)2固体 | |
| D. | 检验某溶液中是否含有H+时,可滴入少量的酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 250 mL | C. | 500 mL | D. | 1000 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L的盐酸500mL,应选用的仪器有胶头滴管、烧杯、玻璃棒、天平、500mL容量瓶 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 | |
| D. | 测定硫酸铜晶体中结晶水含量,加热坩埚中晶体完全失水后需在空气中冷却,再称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “萃取”实验中,振荡后,需要打开分液漏斗活塞,使漏斗内气体放出 | |
| B. | “浓硫酸稀释”实验中,将水慢慢注入浓硫酸中,并不断搅拌 | |
| C. | “实验室制取氢气”实验中,收集装置与氯气的收集装置相同 | |
| D. | “测定气体摩尔体积”实验中,若温度高于0℃,气体摩尔体积一定大于22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能源的优点是热值高、无污染 | |
| B. | 与铜质水龙头连接处的铁质水管易发生锈蚀 | |
| C. | 放在冰箱电的食品保存时间较长,与温度对反应速率的影响有关 | |
| D. | 铅蓄电池放电时,电能转变为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com