有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C 2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小.回答下列问题:
(1)C 2+离子与D原子的结构示意图分别为:______、______.
(2)B和E形成的两种化合物的电子式是:______、______
其中之一可与A 和B形成的化合物反应得到游离态B,写出该反应的化学方程式:______.
(3)由这五种元素中的几种形成的化合物中碱性最强的是______(化学式),含氧酸酸性最强的是______(化学式).
【答案】
分析:有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体,则A为H元素;B原子最外层电子数是次外层电子数的3倍,则最外层电子数为6,即B为O元素;C
2+与B元素的离子具有相同的电子层结构,则C的质子数为8+2+2=12,即C为Mg元素;D与E原子具有相同的电子层数,且次外层电子数均为8,则D、E均在第三周期,在同周期主族元素中原子半径E最大,D最小,则E为Na,D为Cl,然后利用元素及其单质、化合物的性质来解答.
解答:解:有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体,则A为H元素;B原子最外层电子数是次外层电子数的3倍,则最外层电子数为6,即B为O元素;C
2+与B元素的离子具有相同的电子层结构,则C的质子数为8+2+2=12,即C为Mg元素;D与E原子具有相同的电子层数,且次外层电子数均为8,则D、E均在第三周期,在同周期主族元素中原子半径E最大,D最小,则E为Na,D为Cl,
(1)镁离子的结构示意图为
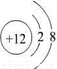
,氯原子的结构示意图为
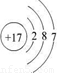
,故答案为:
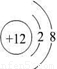
;

;
(2)B和E形成的两种化合物为Na
2O、Na
2O
2,电子式分别为
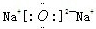
、
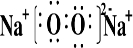
,过氧化钠与水反应生成氧气,反应的化学方程式为
2Na
2O
2+2H
2O=4NaOH+O
2↑,
故答案为:
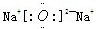
;
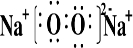
;2Na
2O
2+2H
2O=4NaOH+O
2↑;
(3)五种元素中,Na的金属性最强,则NaOH的碱性最强;Cl的非金属性最强,则HClO
4的酸性最强,
故答案为:NaOH;HClO
4.
点评:本题考查位置、结构、性质的关系及应用,明确元素的推断是解答本题的关键,并注意元素的性质及化学用语的正确使用来解答即可,难度中等.

 ,氯原子的结构示意图为
,氯原子的结构示意图为 ,故答案为:
,故答案为: ;
; ;
;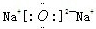 、
、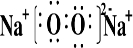 ,过氧化钠与水反应生成氧气,反应的化学方程式为
,过氧化钠与水反应生成氧气,反应的化学方程式为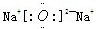 ;
;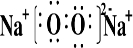 ;2Na2O2+2H2O=4NaOH+O2↑;
;2Na2O2+2H2O=4NaOH+O2↑;

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案










