
| A、△H1>0,△H3<0 |
| B、△H2<0,△H4>0 |
| C、△H2=△H1-△H3 |
| D、△H3=△H4+△H5 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
 常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )
常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )| A、H2A是一种二元弱酸 |
| B、常温下,H2A=H++HA-的电离平衡常数Ka1=0.01 |
| C、将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液pH一定为5.5 |
| D、在量热计中,用20.0mL0.10mol/LnaOH溶液,分别与10.0mL0.20mol/LH2A和20.0mL0.10mol/LH2A反应后放出的热量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沙子的主要成分是SiO2,可以用来制作电脑芯片 |
| B、Na失火不能用CO2灭火,Mg失火也不能用CO2灭火 |
| C、世博会中国馆“东方之冠”适用的钢筋混凝土属于有机化合物 |
| D、硬铝、钢铁、青铜、金都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
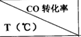 | 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 40% | 70% | 80% | 80% |
| T 2 | 55% | 65% | a1 | a2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁制品上镀锌的阳极反应式:Zn-2e-=Zn2+ |
| B、用两个铁电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为Cu-2e-=Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铜做电极电CuSO4解溶液:2Cu2++2H2O
| ||||
| B、在NH4Fe(SO4)2溶液中,滴加少量Ba(OH)2溶液:2NH4++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ | ||||
| C、在Na2CO3溶液中逐滴滴入稀盐酸溶液,反应开始阶段:CO32-+H+═HCO3- | ||||
| D、在Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com