
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
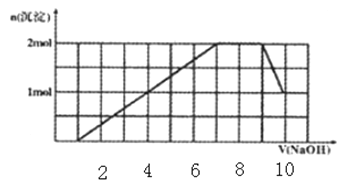
A. 原溶液中含有的Fe3+和Al3+的物质的量之比为1 : 1
B. 原溶液中一定含有SO42-和Na+
C. 反应最后形成的溶液中含有的溶质为Na2SO4
D. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
【答案】A
【解析】
A.根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故A正确;B.根据A的推断,解题图象第二段和最后剩余沉淀的量,可以知道氢氧化铝的沉淀量和另一沉淀的量是相等的,即一定是三价铁离子,一定不含有镁离子,所以含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不含碳酸根离子,溶液必须是呈电中性,故一定有阴离子SO42-,不能确定钠离子是否存在,故B错误;C.加入NaOH溶液,钠离子实际不参加反应,则反应后溶液中钠离子一定存在,最后溶液中含有的溶质为Na2SO4和偏铝酸钠,故C错误;D.根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故D错误;故答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料B.耐高温、耐腐蚀的合金材料
C.半导体材料D.制农药的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.与煤、石油相比较,天然气是一种比较清洁的化石燃料
B.乙醇是一种可再生能源,作为燃料的优点是完全燃烧的产物不污染环境
C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量
D.煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化毫无意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纤维素水解的最终产物为葡萄糖B.油脂的皂化反应属于加成反应
C.聚乙烯能使溴的四氯化碳溶液褪色D.蛋白质遇金属离子会变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的说法不正确的是
A.NH3可用作消毒剂
B.明矾可用作净水剂
C.Na2CO3可用于洗涤油污
D.铁粉可作为食品的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列三个反应:①Cl2 +FeI2 =FeCl2 +I2 ②2Fe2+ +Br2 =2Fe3+ +2Br- ③Co2O3 +6HCl=2CoCl2 +Cl2↑+3H2 O下列说法正确的是
A. ①②③中的氧化产物分别是I2 、Fe3+ 、CoCl2
B. 根据以上方程式可以得到氧化性Cl2 >Fe3+ >Co2O3
C. 在③反应中当1molCo2O3 参加反应时,2molHCl被氧化
D. 可以推理得到Cl2 +FeBr2 =FeCl2 +Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是世界上用量最大的金属,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为______________________________;34.8g Fe3O4与足量稀硝酸反应,被还原的HNO3物质的量为____________mol。
(2)FeCl3溶液是一种黄色透明液体,可用作止血剂,其原因是__________________;向煮沸的蒸馏水中加入几滴饱和FeCl3溶液,继续煮沸得到红褐色的Fe(OH)3胶体,鉴别FeCl3溶液与Fe(OH)3胶体的方法是__________________________________________________________________。
(3)高铁酸钠(Na2FeO4)是一种绿色水处理剂,具有杀菌消毒和聚沉水中杂质的作用,它的杀菌消毒原理是________________________________________;高铁电池是一种新型可充电电池,高铁电池的总反应为3Zn+2Na2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为___________________。
3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为___________________。
(4)铁红是一种重要的红色颜料,其主要成分是Fe2O3,将一定量的铁红溶于130mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L气体(标准状况),向反应后溶液中加入几滴KSCN溶液,溶液不变红色,则参加反应的铁粉质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列各量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体的总质量⑧混合气体的总体积⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧ B.①③④⑤⑧⑨ C.①②③④⑤⑦ D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com