
【题目】下列属于化合反应的是
A. Zn +2AgNO3== Zn (NO3)2 + 2Ag B. 2FeCl2 + Cl2 == 2FeCl3
C. Cu(OH)2+ 2HCl == CuCl2+ 2 H 2O D. CaCO3![]() CaO+ CO2↑
CaO+ CO2↑
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
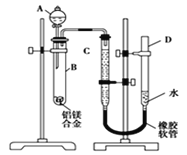
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________________
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是____________(填序号);记录C的液面位置时,除平视外,还应____________________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
(5)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器是胶头滴管、玻璃棒和_____________________(填仪器规格和名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3+ + 3OH- =Fe(OH)3↓ |
B | K+、ClO-、SO42- | 盐酸 | H++ClO- =HClO |
C | K+、OH-、Cl- | 过量SO2 | SO2+ OH-=HSO3- |
D | H+、Fe2+、 SO42- | Ba(NO3)2溶液 | SO42-+ Ba2+ =BaSO4↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3,学名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理等。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶物
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_____mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =____________mol/L.
(3)将50mL 0.1mol/L FeCl3和50mL 0.5mol/L CaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为_____mol/L.
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,且苯环上的一氯代物只有二种,A的结构简式为________,写出A与浓溴水反应的方程式________。
(5)FeCl3可制备氢氧化铁胶体处理污水,处理污水时发生了__________(物理或化学)变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α丙氨酸是组成人体蛋白的氨基酸之一,如图是α丙氨酸的分子结构模型图,下列对α丙氨酸的叙述不正确的是( )
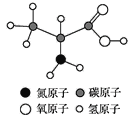
A. α丙氨酸分子由碳、氢、氧、氮四种原子构成
B. α丙氨酸中氧元素的质量分数最大
C. α丙氨酸的分子式为C3H7O2N
D. α丙氨酸与CH3CH2CH2NO2以及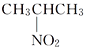 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-===CO32-+7H2O;Y极:4H2O+2O2+8e-===8OH-。下列关于此燃料电池的说法中,错误的是( )
A. X为负极,Y为正极
B. 工作一段时间后,KOH的物质的量减少
C. 在标准状况下,通入5.6 L O2完全反应后,有1 mol电子发生转移
D. 该电池工作时,X极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:
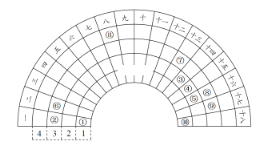
(1)⑤元素形成的简单阴离子的结构示意图为________。
(2)④的气态氢化物的电子式为_____。
(3)在11种元素中,单质的化学性质最不活泼的是_______。(填化学式)
(4)⑧⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是________。(填化学式)
(5)③的单质可以和⑧的最高价氧化物的水化物的浓溶液反应,请写出有关反应的化学方程式____________。
(6)⑦在元素周期表中的位置是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com