
【题目】铜及其化合物在生产生活及科学研究方面应用非常广泛。
(1)铜元素基态原子的电子排布式为________,铜晶体中的原子堆积模型属于______(填堆积模型名称)。
(2)金属铜的导电性仅次于银,大量用于电气工业。请解释金属铜能导电的原因:______。
(3)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4的熔点更高的原因是______。
(4)如图所示是铜与金的一种合金晶体的立方晶胞。

①该晶体中,Cu与Au的原子个数比为_________。
②原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0,0,0),B为(0,![]() ,
,![]() ),则C原子(底心)的坐标参数为__________。
),则C原子(底心)的坐标参数为__________。
③已知该立方晶胞的密度为![]() ,NA为阿伏加德罗常数的值,则晶胞参数a=______nm。
,NA为阿伏加德罗常数的值,则晶胞参数a=______nm。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 面心立方最密堆积 铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动 CuSO4和Cu(NO3)2均为离子晶体,![]() 所带电荷数比
所带电荷数比![]() 多,故CuSO4晶体的晶格能较大,熔点较高 3:1 (
多,故CuSO4晶体的晶格能较大,熔点较高 3:1 (![]() ,
,![]() ,0)
,0) 
【解析】
(1)基态铜原子核外有29个电子,电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,Cu形成的晶体为金属晶体,其堆积模型为面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;面心立方最密堆积;
(2)铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动,因此铜可以导电,故答案为:铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动;
(3)CuSO4和Cu(NO3)2均为离子晶体,![]() 所带电荷数比
所带电荷数比![]() 多,故CuSO4晶体的晶格能较大,晶格能越大,熔沸点越高,故答案为:CuSO4和Cu(NO3)2均为离子晶体,
多,故CuSO4晶体的晶格能较大,晶格能越大,熔沸点越高,故答案为:CuSO4和Cu(NO3)2均为离子晶体,![]() 所带电荷数比
所带电荷数比![]() 多,故CuSO4晶体的晶格能较大,熔点较高;
多,故CuSO4晶体的晶格能较大,熔点较高;
(4)①Cu位于面心,个数为![]() ,Au位于顶点,个数为
,Au位于顶点,个数为![]() ,则Cu、 Au的个数比为3:1,故答案为:3:1;
,则Cu、 Au的个数比为3:1,故答案为:3:1;
②由于B、C原子同位于面心处,则C原子的坐标参数为(![]() ,
,![]() ,0),故答案为:(
,0),故答案为:(![]() ,
,![]() ,0);
,0);
③以该晶胞为研究对象,该晶胞的化学式为Cu3Au,由公式:![]() 可得,晶胞的质量为
可得,晶胞的质量为![]() ,则
,则 ,故答案为:
,故答案为: 。
。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.基态R原子的轨道表示式为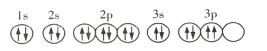
B.![]() 与
与![]() 的半径大小关系为
的半径大小关系为![]()
C.Y的第一电离能大于X的第一电离能
D.X、Y、Z、R、W中,电负性最大的元素为W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法正确的是( )
A.实验① 5min达平衡,平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=1
C.实验②中,达到平衡时,a小于0.16
D.正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某科学工作者通过![]() 射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。
射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。

①写出基态Cu原子的核外电子排布式:__。
②写出图中水合铜离子的结构简式(必须将配位键表示出来):__。
(2)很多不饱和有机物在Ni的催化作用下可以与H2发生加成反应,如①CH2=CH2、②CH![]() CH、③
CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法错误的是( )
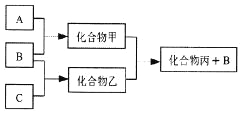
A. Z元素位于第二周期第VIA族
B. 可用排水法收集化合物乙
C. 元素X、Y、Z的原子半径大小关系为X<Z<Y
D. 化合物甲溶于化合物丙中,存在的微粒有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素的性质或结构信息如下表所示,请回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质在常温下为固体,难溶于水,易溶于CS2。能形成两种二元含氧酸 | 原子的M层有1个未成对的p电子,核外p电子总数大于7 | 单质曾被称为“银色的金子”与锂形成的合金常用于制造航天飞行器。单质能溶于强酸和强碱溶液 | 原子核外电子层上s电子总数比p电子总数少2。单质和氧化物均为空间网状结构,具有很高的熔、沸点 |
(1)A原子的最外层电子排布式为_______________,D原子核外共有____________个电子。
(2)写出C的单质与强碱溶液反应的离子方程式:______________________________________________。
(3)A、B两元素的氢化物分子中键能较小的是__________________________(填分子式);分子较稳定的是__________________(填分子式)。
(4)E、D同主族,均为短周期元素。它们的最高价氧化物晶体中熔点较高的是________________。
(5)已知D的单质的晶体结构与SiC的晶体结构相似,其中C原子的杂化方式为______________。SiC与D的单质的晶体的熔、沸点高低顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学和生活、社会发展息息相关,从古代文物的修复到现在的人工智能,我们时时刻刻能感受到化学的魅力。下列说法不正确的是
A. 银器发黑重新变亮涉及了化学变化
银器发黑重新变亮涉及了化学变化
B. 煤综合利用时采用了干馏和液化等化学方法
煤综合利用时采用了干馏和液化等化学方法
C. 瓷器主要成分属于硅酸盐
瓷器主要成分属于硅酸盐
D. 芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①![]()
②![]()
回答下列问题:
(1)A的化学名称是______________________。
(2)由C生成D和E生成F的反应类型分别是_____________________、____________________。
(3)E的结构简式为______________________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式:_______________。
(6)写出用环戊烷和2-丁炔为原料制备化合物的合成路线(其他试剂任选) _______________。
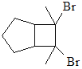
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试用相关知识回答下列问题:
(1)有机物大多难溶于水,而乙醇和乙酸可与水互溶,原因是_______。
(2)乙醚(![]() )的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是_________________。
(3)从氨合成塔里分离出NH3,通常采用的方法是_____________,原因是_____________。
(4)水在常温下的组成的化学式可用(H2O)n表示,原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com