
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 原电池负极发生氧化反应 | |
| C. | 原电池中,阳离子向负极移动 | |
| D. | 原电池电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
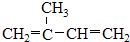 ⑤ClCH=CHCl ⑥
⑤ClCH=CHCl ⑥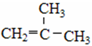 ⑦
⑦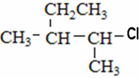 ⑧
⑧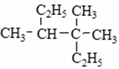 ⑨
⑨
 .
.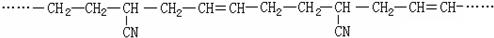
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
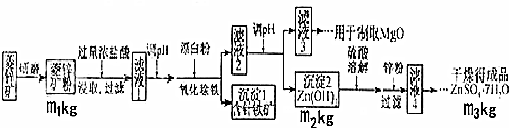
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com