
 4C(g)���ﵽ��ѧƽ��ʱ���c(A)��0.2 mol��L��1��ѹ������ʹѹǿ����2.02��106 Pa���ڶ��δﵽƽ��ʱ�����c(A)��0.36 mol��L��1��������ѹ��������ʹѹǿ����5.05��106 Pa�������δﵽƽ��ʱ�����c(A)��1.1 mol��L��1���������й�˵������ȷ���� (����)
4C(g)���ﵽ��ѧƽ��ʱ���c(A)��0.2 mol��L��1��ѹ������ʹѹǿ����2.02��106 Pa���ڶ��δﵽƽ��ʱ�����c(A)��0.36 mol��L��1��������ѹ��������ʹѹǿ����5.05��106 Pa�������δﵽƽ��ʱ�����c(A)��1.1 mol��L��1���������й�˵������ȷ���� (����)


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4�Ŀ��淴Ӧ��,����״̬һ������ƽ��״̬����(����)
N2O4�Ŀ��淴Ӧ��,����״̬һ������ƽ��״̬����(����)| A��N2O4��NO2�ķ�������Ϊ1��2 |
| B��N2O4��NO2��Ũ����� |
| C��ƽ����ϵ����ɫ���ٸı� |
| D����λʱ������1 mol N2O4��ΪNO2��ͬʱ,��2 mol NO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�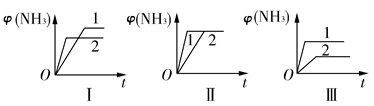
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2>p1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1>p2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2 |
| D��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1>2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
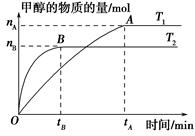
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��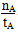 mol��L��1��min��1 mol��L��1��min��1 |
| B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С |
| C���÷�ӦΪ���ȷ�Ӧ |
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ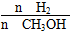 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
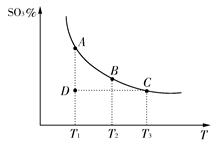
 2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������ͼʾ�ش��������⣺
2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������ͼʾ�ش��������⣺ 2SO3(g)�Ħ�H________0(�>����<��)�����ں��£���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ��________�ƶ�(��������ҡ�����)��
2SO3(g)�Ħ�H________0(�>����<��)�����ں��£���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ��________�ƶ�(��������ҡ�����)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)��H2(g)�ﵽƽ��ı�־��(����)
CO(g)��H2(g)�ﵽƽ��ı�־��(����)| A������Ӧ���淴Ӧ���ʾ�Ϊ�� |
| B��v(H2O����)��v(CO����) |
| C����λʱ���ڷ�Ӧ����ٵķ������������������ӵķ����� |
| D��ѹǿ����ʱ��ı仯���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2D(g) ��H=Q kJ��mol-1��������������ݼ��±���
2D(g) ��H=Q kJ��mol-1��������������ݼ��±���| | ʵ��� | ʵ��� | ʵ��� |
| ��Ӧ�¶�/�� | 800 | 800 | 850 |
| �ﵽƽ������ʱ��/min | 40 | a | 30 |
| D����ƽ��Ũ��/mol��L-1 | 0.5 | b | 0.6 |
| ��Ӧ�������仯/ kJ | Q1 | Q2 | Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)�ﵽƽ��ı�־��(����)��
2C(g)�ﵽƽ��ı�־��(����)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)+CO2(g) ��H="-41.2" kJ/mol�Ʊ�CO2��H2�Ļ������,����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g) ��H="-41.2" kJ/mol�Ʊ�CO2��H2�Ļ������,����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�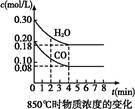
| A���ﵽƽ��ʱ,���������ʵ�����0.12 mol |
| B���ﵽƽ��ʱ,��Ӧ��ϵ���ջ�ų�49.44 kJ���� |
| C����4 minʱ,��������ƽ����Է����������ٱ仯 |
| D����6 minʱ,�������¶�,��Ӧƽ�ⳣ�����С |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com