
【题目】海水淡化及海水资源的提取利用是当今化工行业重要课题。
回答下列问题:
(1)下列属于海水淡化常见工艺的是________(填序号)。
①电渗析法 ②蒸馏法 ③离子交换法 ④沉淀法
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是 Br2+Na2CO3+H2O→ NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子为________mol。
(3)海水提镁的一段工艺流程如下图:
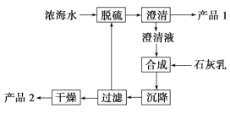
浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为____________________________________________,产品2 的化学式为________,1 L 浓海水最多可得到产品2 的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:_______________。电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:__________________
【答案】
(1)①②③
(2)![]()
(3)Ca2++SO42- ===CaSO4↓ Mg(OH)2 69.6
(4)MgCl2(熔融)![]() Mg+Cl2↑ Mg+2H2O
Mg+Cl2↑ Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
【解析】
试题分析:(1)蒸馏法、离子交换法、电渗析法都是常见海水淡化的方法,故答案为①、②、③;
(2)一般用氯气或过氧化氢氧化Br-,反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×![]() ×5=
×5=![]() mol,故答案为:
mol,故答案为:![]() mol;
mol;
(3)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓:
②采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×![]() =69.6g;
=69.6g;
(4)电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2(熔融)![]() Mg+Cl2↑;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗,反应方程式为:Mg+2H2O
Mg+Cl2↑;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗,反应方程式为:Mg+2H2O![]() Mg(OH)2+H2↑。
Mg(OH)2+H2↑。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
A.增大氧气浓度,平衡正向移动,平衡常数不变
B.降低温度,正反应速率比逆反应速率减小的程度小
C.平衡时SO2气体的转化率为50%
D.该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期主族元素的性质或原子结构如下表:

(1)元素Y在周期表中的位置_________(周期、族)。
(2)XN2的电子式是:_________,Y的简单氢化物的结构式_________。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________。
(4)用电子式表示WZ的形成过程_________。
(5)元素Z和T相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________。
A.常温下Z单质和T单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式_________,所得溶液的溶质是_________化合物(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2![]() CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: .
(2)硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4(硼元素的化合价在该过程中不发生变化)和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

电极b为 (填“正极”或“负极”),
电极a上发生反应的电极反应式为 .
(3)电池工作时,Na+向 极(填“a”或“b”)移动,
当左槽产生0.0125mol BO2﹣离子时,右槽溶液c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 “侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。
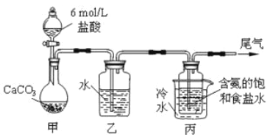
(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:
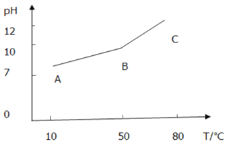
当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)

(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量是衡量一个国家石油化工发展水平的标志,他们之间并能进行如图所示的相互转化。
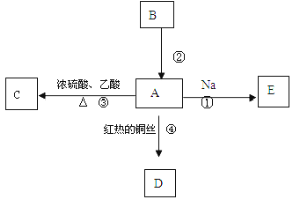
(1)写出A的化学式_________。
(2)写出下列反应的化学方程式
反应①:______________________;
反应③:______________________;
反应④:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com