
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
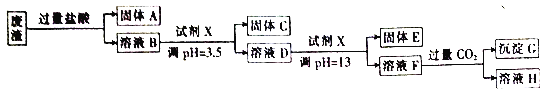
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
【答案】 Fe(OH)3 氢氧化钠 经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=A1O2-+2H2O 镁离子沉淀不完全或氢氧化铝溶解不完全 A1O2-+CO2+2H2O=Al(OH)3↓+HCO3- 10-11
【解析】废渣中加入过量的盐酸,MgO、Al2O3、Fe2O3分别溶解生成相应的Mg2+ 、Al3+、 Fe3+,而SiO2不溶解,所以固体A为SiO2;溶液B中加入试剂X,调节pH=3.7生成固体C为氢氧化铁,溶液D中加入试剂X,调溶液pH=13,则产生氢氧化镁沉淀,说明此时铝离子应以偏铝酸根子存在,在试剂X为强碱情况下,溶液F含有偏铝酸根离子与通入足量的二氧化碳气体反应,生成氢氧化铝沉淀,溶液H中含有碳酸氢根离子。
(1)固体C应为Fe(OH)3固体;正确答案:Fe(OH)3。
(2)根据题给信息可知饱和氨水溶液中c(OH-)约为1×10-3mol/L,溶液pH=11,所以只能选择强碱溶液调节溶液调至pH=13,因此上述流程中两次使用试剂均为氢氧化钠溶液;正确答案:氢氧化钠 ;经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性。
(3)D溶液中含有Mg2+、Al3+;逐滴加入氢氧化钠溶液,Al3+先与OH-反应生成Al(OH)3沉淀,然后Al(OH)3继续与过量的氢氧化钠溶液反应,生成偏铝酸根离子,沉淀溶解,离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=A1O2-+2H2O;正确答案:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=A1O2-+2H2O。
(4)溶液D(含有Mg2+、Al3+)→固体E(Mg(OH)2)的过程中需要控制溶液pH=13,如果pH过小,导致氢氧化钠溶液加的量不足,会导致镁离子沉淀不完全或氢氧化铝固体溶解不完全;正确答案:镁离子沉淀不完全或氢氧化铝溶解不完全。
(5)溶液F为偏铝酸钠溶液,通入足量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:A1O2-+CO2+2H2O=Al(OH)3↓+HCO3-;正确答案:A1O2-+CO2+2H2O==Al(OH)3↓+ HCO3-。
(6)根据题给信息可知:阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L),即c(Mg2+)=10-5mol/L,溶液的pH=11时,氢氧化镁沉淀完全,c(OH-)=10-3 mol/L, Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=10-5×(10-3)2=10-11;正确答案:10-11。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,下列说法正确的是
A. 氧化产物与还原产物物质的量之比5∶2
B. 2mol KMnO4完全反应,转移的电子数为16NA
C. 该反应中HCl做还原剂,KCl、MnCl2是氧化产物
D. 氧化剂与还原剂的物质的量之比5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钡钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇(![]() )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

(1)电解食盐水时,总反应的离子方程式______________。
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是________________________。
(3)已知:①![]()
![]() H=
H=![]()
②![]()
![]() H=
H=![]()
则![]()
![]() H=_____________。
H=_____________。
(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:________________。
(5)某自来水中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
物质 |
|
|
|
|
|
|
溶解度( |
|
|
|
|
| 26.7 |
①请用化学方程式表示锅炉中的水垢含有![]() 而不含有
而不含有![]() 的原因:_______。
的原因:_______。
②锅炉中的水垢所含有的![]() 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, ![]() 能转化为物质Y的离子方程式_________。
能转化为物质Y的离子方程式_________。
③水中的![]() 、
、![]() 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与![]() 、
、![]() 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含![]() 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中![]() 的物质的量浓度是________。
的物质的量浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用氯酸钾和二氧化锰制取氧气,反应后从剩余固体中回收纯净的二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤D.溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年中国首次海域可燃冰(CH4·nH2O,密度ρ1g·cm-3)试开采成功。若以辛烷代表汽油(密度ρ2g·cm-3)的组成,下列说法不正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H 1=-a kJ·mol-1
②2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H2 =-bkJ·mol-1
A. 可燃冰适宜保存在低温,高压的环境中
B. 1m3可燃冰可释放出标准状況下[22.4ρ1/(16+18n)]m3的CH4
C. 汽油的燃烧热约为0.5b kJ·mol-1
D. 1m3可燃冰释放出的甲烷燃烧放出的热量约为等体积汽油的[228aρ1/(16+18n)bρ2]倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】江苏正在建设世界最大的海上风电场,防腐蚀是海上风电的突出问题,下列说法正确的是
A. 海水的pH一般在8.0~8.5,对风电钢铁支架的腐蚀主要是析氢腐蚀
B. 腐蚀总反应为4Fe+3O2+2xH2O==2[Fe2O3·xH2O](铁锈)的△H<0,△S<0
C. 钢部件镀锌前,可用碱液洗去表面的铁锈
D. 热喷涂锌铝合金,可以减缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2mol CO2,在不同温度下反应CO2 (g)+C(s) ![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中I、II、III点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中I、II、III点均处于曲线上)。下列说法正确的是

A. 反应CO2(g)+c(s)![]() 2CO(g) △H<0
2CO(g) △H<0
B. 体系的总压强P总:P总(状态Ⅱ)![]() 2P总(状态III)
2P总(状态III)
C. 体系中c(CO):6c(CO,状态I)<c(CO,状态II)
D. 从状态I到状态III的升温过程中,每一时刻,正逆反应速率:υ逆>υ正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关氨及铵盐的叙述中,不正确的是
A. 铵盐是农业上常用的化肥
B. 氨的喷泉实验体现了氨的溶解性和氧化性
C. 实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气
D. 氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A. ⑤①②③④ B. ③⑤①②④
C. ⑤②③①④ D. ②①③⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com